题目内容
6.二甲醚和乙醇是同分异构体,下列方法中不能将二者区分开的是( )| A. | 利用金属钠 | B. | 利用核磁共振氢谱 | ||
| C. | 利用红外光谱法 | D. | 利用质谱法 |
分析 二甲醚和乙醇是同分异构体,乙醇中含有-OH,可发生取代反应,含有C-C、C-O、O-H、C-H键,乙醚含有C-C、C-H、C-O键,二者含有的共价键类型和氢原子的种类不同,以此解答.
解答 解:A.乙醇含有-OH,可与金属钾或钠反应生成氢气,但二甲醚不反应,故A不选;
B.二者含有氢原子的种类不同,可鉴别,故B不选;
C.二者含有的官能团和共价键的种类不同,可鉴别,故C不选;
D.利用质谱法,因二者的相对分子质量相等,则不能鉴别,故D选;
故选D.
点评 本题考好有机物的鉴别,难度不大,注意把握有机物结构的不同,把握常见鉴别方法.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
14.有关钢铁电化学腐蚀及保护的下列叙述中正确的是( )
| A. | 钢铁的电化学腐蚀过程可用原电池或电解池的原理来解释 | |
| B. | 可将河道中的钢铁闸门与外加直流电源的负极相连以保护其不受腐蚀 | |
| C. | 在钢铁表面镀锌属于牺牲阳极阴极保护法 | |
| D. | 钢铁的电化学腐蚀中,主要是吸氧腐蚀 |
1.如表物质所属的类别及其所含官能团的对应关系可能有错误的是( )
| 物质 | 类别 | 官能团 | |
| A | CH3CH=CH2 | 烯烃 |  |
| B | (CH3)2 CHCOOH | 羧酸 | -COOH |
| C | HCOOCH2- | 酯类 | -COOR |
| D | R-OH(R,烃基) | 醇类 | -OH |
| A. | A | B. | B | C. | C | D. | D |
11.韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”.下列关于“暖冰”的说法正确的是( )
| A. | 暖冰中水分子是直线型分子 | |
| B. | 水凝固形成20℃时的“暖冰”所发生的变化是化学变化 | |
| C. | 暖冰中水分子是分子密堆积 | |
| D. | 在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰” |
16.下列溶液一定呈中性的是( )
| A. | 使石蕊试液呈紫色的溶液 | |
| B. | c(H+)=c(OH-)=10-6mol/L溶液 | |
| C. | pH=7的溶液 | |
| D. | 酸与碱恰好完全反应生成正盐的溶液 |
 Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
 .
.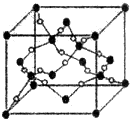 A、B、C、D、E、F、G六种元素的原子序数依次增大.A的离子和B的内层电子数相同,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,A与C能形成AC3分子且VSEPR模型为四面体形,D原子p轨道成对电子数等于未成对电子数,E原子核外每个原子轨道上的电子都已成对,F原子的最外层电子数等于其周期序数,E和F位于同一周期.G是第四周期的元素,最外层电子数与A相同且内层均填充满电子.
A、B、C、D、E、F、G六种元素的原子序数依次增大.A的离子和B的内层电子数相同,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,A与C能形成AC3分子且VSEPR模型为四面体形,D原子p轨道成对电子数等于未成对电子数,E原子核外每个原子轨道上的电子都已成对,F原子的最外层电子数等于其周期序数,E和F位于同一周期.G是第四周期的元素,最外层电子数与A相同且内层均填充满电子.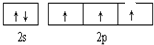 ,与AC3分子互为等电子体的阳离子为H3O+;
,与AC3分子互为等电子体的阳离子为H3O+;