题目内容
1.关于下列各组物质说法正确的是( )| A. | 苯和甲苯不互为同系物 | B. | 淀粉和纤维素互为同分异构体 | ||
| C. | 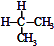 与 与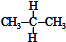 互为同分异构体 互为同分异构体 | D. | 异丁烷与2-甲基丙烷互为同种物质 |
分析 A.结构相似、分子组成相差若干个“CH2”原子团的有机化合物互相称为同系物;
B.淀粉、纤维素的分子式不一定相同;
C.甲烷是正四面体结构;
D.异丁烷就是2-甲基丙烷.
解答 解:A.苯和甲苯结构相似,分子组成相差1个“CH2”原子团,故互为同系物,故A错误;
B.淀粉、纤维素都为高聚物,n介于较大的范围之间,不确定,则二者的分子式不一定相同,则不是同分异构体,故B错误;
C.甲烷是正四面体结构,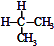 与
与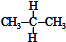 是同种物质,故C错误;
是同种物质,故C错误;
D.异丁烷就是2-甲基丙烷,是同种物质,故D正确.
故选D.
点评 本题考查同系物、同分异构体的概念分析、比较,难度不大,注意概念的理解与应用,把握“五同”是指同位素、同素异形体、同系物、同分异构体、同种物质,注意从相同的内容、不同的内容、使用范围等方面掌握判断的方法和技巧.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
11. 某同学按如图所示的装置(a、b是电极,c为电解质溶液)分别进行了下表列出的四组实验:
某同学按如图所示的装置(a、b是电极,c为电解质溶液)分别进行了下表列出的四组实验:
则有关叙述正确的是( )
 某同学按如图所示的装置(a、b是电极,c为电解质溶液)分别进行了下表列出的四组实验:
某同学按如图所示的装置(a、b是电极,c为电解质溶液)分别进行了下表列出的四组实验:| 组别 | a | b | c中的溶质 |
| 甲 | C | C | KOH |
| 乙 | Cu | Cu | NaCl |
| 丙 | Cu | Cu | CuSO4 |
| 丁 | C | C | NaCl |
| A. | 甲实验中溶液的pH要变小,两极均有气体放出 | |
| B. | 乙实验中发生反应的总反应式为:Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$ Cu(OH)2↓+H2↑ | |
| C. | 丙实验中c溶液的浓度不变,a极质量增大 | |
| D. | 丁实验中a极电极反应式为:2H++2e-═H2↑ |
12.下列有关叙述错误的是( )
| A. | 纤维素和高级脂肪酸都是高分子化合物 | |
| B. | 天然油脂一般为多种混甘油酯的混合物,因此无固定的熔沸点 | |
| C. | 皂化反应完成后加入食盐可以使高级脂肪酸钠从混合物中析出,这一过程叫盐析 | |
| D. | 区别植物油和矿物油的正确方法是将它们分别加入氢氧化钠溶液,加热、振荡,观察是否分层 |
9.为了证明甲酸溶液中含有甲醛,正确的操作是( )
| A. | 滴入石蕊试液 | |
| B. | 加入金属钠 | |
| C. | 加入银氨溶液(微热) | |
| D. | 加入氢氧化钠溶液后加热蒸馏,在馏出物中加入银氨溶液(微热) |
6.已知两瓶气体分别是HCl 和Cl2,可以区别它们的方法或试剂是( )
①观察颜色 ②打开瓶盖看有无白雾 ③湿润的淀粉试纸 ④湿润的红色石蕊试纸⑤湿润的蓝色石蕊试纸 ⑥AgNO3溶液.
①观察颜色 ②打开瓶盖看有无白雾 ③湿润的淀粉试纸 ④湿润的红色石蕊试纸⑤湿润的蓝色石蕊试纸 ⑥AgNO3溶液.
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ①②④⑤ | D. | ①②③⑥ |
13.在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
回答下列问题:
(1)该反应化学平衡常数的表达式:K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$;
(2)该反应为吸热(填“吸热”或“放热”)反应;
(3)下列说法中能说明该反应达平衡状态的是B
A.容器中压强不变 B.混合气体中c(CO)不变
C.混合气体的密度不变 D.c(CO)=c(CO2)
E.单位时间内生成CO的分子数与生成H2O的分子数相等
(4)为了提高H2的转化率,下列措施可行的是D
A.降低温度 B.使用催化剂
C.增大压强 D.循环利用和不断补充CO2
(5)某温度下,各物质的平衡浓度符合下式:c(CO2)×c(H2)=c(CO)×c(H2O),试判此时的温度为830℃.
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应化学平衡常数的表达式:K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$;
(2)该反应为吸热(填“吸热”或“放热”)反应;
(3)下列说法中能说明该反应达平衡状态的是B
A.容器中压强不变 B.混合气体中c(CO)不变
C.混合气体的密度不变 D.c(CO)=c(CO2)
E.单位时间内生成CO的分子数与生成H2O的分子数相等
(4)为了提高H2的转化率,下列措施可行的是D
A.降低温度 B.使用催化剂
C.增大压强 D.循环利用和不断补充CO2
(5)某温度下,各物质的平衡浓度符合下式:c(CO2)×c(H2)=c(CO)×c(H2O),试判此时的温度为830℃.
10.地壳中含量占第1、2位的元素间形成的化合物,不具有的性质是( )
| A. | 常温下与水反应生成酸 | B. | 高温时能与纯碱反应 | ||
| C. | 熔点高,硬度大 | D. | 常温下能与NaOH溶液反应 |
11.韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”.下列关于“暖冰”的说法正确的是( )
| A. | 暖冰中水分子是直线型分子 | |
| B. | 水凝固形成20℃时的“暖冰”所发生的变化是化学变化 | |
| C. | 暖冰中水分子是分子密堆积 | |
| D. | 在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰” |
 Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
 .
.