题目内容
11.具有一个醇羟基的有机物甲与8g乙酸充分反应生成了10.2g乙酸酯,经分析还有2g乙酸剩余,甲可能是下列物质中的( )| A. | C2H5OH | B. | C6H5-CH2-OH | C. | 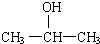 | D. | 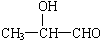 |
分析 参加反应的乙酸的质量为:8g-2g=6g,由羧酸与醇的反应原理可知,参加反应的乙酸的物质的量=有机物甲的物质的量=生成的水的物质的量,根据参加反应的乙酸的质量求出有机物甲的物质的量、生成的水的物质的量,进而求出生成的水的质量,再根据质量守恒定律求出有机物甲的质量,求出有机物甲的相对分子质量,据此进行判断.
解答 解:参加反应的乙酸的质量为:8g-2g=6g,
参加反应的乙酸的物质的量为:$\frac{6g}{g/mol}$=0.1mol,
所以生成的水的质量为:0.1mol×18g/mol=1.8g,
有机物甲的质量为:10.2g+1.8g-6g=6g,甲分子中含有1个羟基,则参加反应的甲的物质的量为0.1mol,
所以机物甲的摩尔质量为:$\frac{6g}{0.1mol}$=60g/mol,
即有机物甲的相对分子质量为60,
选项A、B、D的相对分子质量都不是60,只有C的相对分子质量为60,
故选C.
点评 本题考查混合物反应的计算,题目难度中等,明确酯化反应原理为解答关键,注意掌握质量守恒定律在化学计算中的应用方法,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
2.下列化合物中含有手性碳原子的是( )
| A. | CCl2F2 | B. | CH2OHCHOHCH2OH | C. | CH3CH2OH | D. |  |
19.手性分子具有镜像异构及光学活性,下列分子中具有光学活性的是( )
| A. | CBr2F2 | B. | CH3CH2OH | C. | CH3CH(OH)COOH | D. | CH3CH2CH3 |
6.下列各组混合物,不能用分液漏斗分开的是( )
①四氯化碳、水 ②乙醇、甘油 ③乙醇、水 ④苯、水 ⑤已烷、水 ⑥环已烷、苯 ⑦溴苯、水.
①四氯化碳、水 ②乙醇、甘油 ③乙醇、水 ④苯、水 ⑤已烷、水 ⑥环已烷、苯 ⑦溴苯、水.
| A. | ②③⑥ | B. | ②④⑦ | C. | ①④⑤⑦ | D. | ③④⑥⑦ |
3.下列说法正确的是( )
| A. | 甲烷和乙醇均能发生取代反应 | |
| B. | 蛋白质、淀粉、油脂均能发生水解反应 | |
| C. | 溴乙烷与NaOH水溶液共热生成乙烯 | |
| D. | 油脂和淀粉都是高分子化合物 |
1.如表物质所属的类别及其所含官能团的对应关系可能有错误的是( )
| 物质 | 类别 | 官能团 | |
| A | CH3CH=CH2 | 烯烃 |  |
| B | (CH3)2 CHCOOH | 羧酸 | -COOH |
| C | HCOOCH2- | 酯类 | -COOR |
| D | R-OH(R,烃基) | 醇类 | -OH |
| A. | A | B. | B | C. | C | D. | D |
 Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
 .
.