题目内容
(9分)生产生活中广泛涉及氧化还原反应。
(1)工业上冶炼下列物质通常不采用电解法的是 。
a.Na b.Mg c.Fe d.Ag
(2)下图为电解精炼铜的示意图,电极a为粗铜,则a连接电源的 极,b极的电极反应式为 。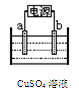
(3)汽车剧烈碰撞时,安全气囊中发生反应NaN3 + KNO3 → K2O + Na2O + X↑(未配平),已知X为单质,在反应中NaN3失去电子。则该反应的氧化剂为 ,X的化学式为 ,该反应的氧化剂和还原剂的物质的量之比为 。
(4)工业上制取高纯度MnO2的某一步骤如图所示,请写出该反应的离子方程式 。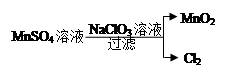
(1)cd (2分)
(2)正(1分) Cu2++2e?="Cu" (1分)
(3)KNO3 N2 1:5 (共3分,各1分)
(4)5Mn2+ + 2ClO3? + 4H2O = 5MnO2↓+ Cl2↑+ 8H+ (2分)
解析试题分析:(1)Na、Mg为活泼金属,无法用还原剂还原化合物制取金属单质,Fe可用还原剂还原化合物制取金属单质,Ag可用加热Ag2O的方法制取Ag,故cd项正确。
(2)电解精炼铜,粗铜为阳极,连接在电源的正极;b极为阴极,电解质溶液中的Cu2+在阴极上得电子,电解方程式为:Cu2++2e?=Cu。
(3)已知X为单质,在反应中NaN3失去电子,可推出X为N2,KNO3中N元素化合价降低,在反应中得电子,所以KNO3为氧化剂;根据氧化反应中氧化剂所得电子总数与还原剂失去电子总数相等,可得n(NaN3)=5n(KNO3),所以氧化剂和还原剂的物质的量之比,即n(KNO3):n(NaN3)=1:5.
(4)根据图示可知,ClO3?把Mn2+氧化为MnO2,可得离子方程式为:5Mn2+ + 2ClO3? + 4H2O = 5MnO2↓+ Cl2↑+ 8H+
考点:本题考查金属的冶炼、电解精炼铜、氧化还原反应原理及应用、离子方程式的书写。

 阅读快车系列答案
阅读快车系列答案镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,并设计出相关实验流程图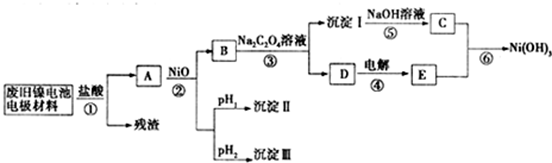
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-33 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
回答下列问题:
(1)根据表数据判断步骤②依次析出沉淀Ⅱ 和沉淀Ⅲ (填化学式),则pH1 pH2(填填“>”、“=”或“<”),控制两种沉淀析出可利用 。
A.pH试纸 B.石蕊指示剂 C.pH计
(2)已知溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O,则反应③的化学方程式是 .第③步反应后,过滤沉淀时需要的玻璃仪器有 .若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因 、 。
(3)④中阳极反应产生的气体E为 ,验证该气体的试剂为 。
(4)试写出反应⑥的离子方程式_____________________________________________
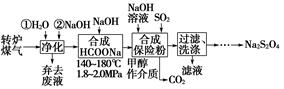
溴及其化合物广泛应用在有机合成、化学分析等领域。
(1)海水提溴过程中溴元素的变化如下: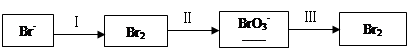
①过程Ⅰ,海水显碱性,调其pH<3.5后,再通入氯气。
ⅰ.通入氯气后,反应的离子方程式是______。
ⅱ.调海水pH可提高Cl2的利用率,用平衡原理解释其原因是______。
②过程Ⅱ,用热空气将溴赶出,再用浓碳酸钠溶液吸收。完成并配平下列方程式。
Br2+ Na2CO3=
Na2CO3= NaBrO3+
NaBrO3+ CO2+
CO2+ ______
______
③过程Ⅲ,用硫酸酸化可得Br2和Na2SO4的混合溶液。
相同条件下,若用盐酸酸化,则所得溴的质量减少,原因是______。
(2)NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6 mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
| 粒子 | I2 | Br2 | IO3- |
| 物质的量/mol | 0.5 | 1.3 | |
某Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol·L-1的盐酸,测得溶液中的C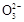 、HC
、HC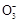 、Al
、Al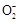 、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是( )
、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是( )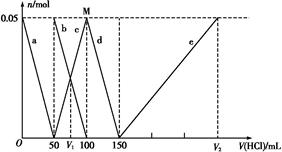
A.原混合溶液中的C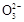 与Al 与Al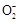 的物质的量之比为1∶2 的物质的量之比为1∶2 |
| B.V1∶V2=1∶5 |
| C.M点时生成的CO2为0.05 mol |
D.a线表示的离子方程式为:Al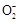 +H++H2O +H++H2O Al(OH)3↓ Al(OH)3↓ |
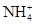 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、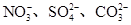 。已知:
。已知: