题目内容
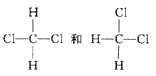
【题目】把1体积CH4和4体积Cl2组成的混合气体充入大试管中。
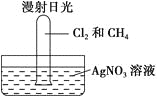
将此试管倒立在盛有AgNO3溶液的水槽中,放在光亮处,片刻后发现试管壁上有油状液滴出现,该油状液滴可能是________,水槽中还观察到________,原因是________(用离子方程式解释)。若向水槽中再滴入几滴紫色石蕊试液又观察到________,原因是___________________________。
【答案】CH2Cl2、CHCl3、CCl4的混合物 有白色沉淀产生 Ag++Cl-=AgCl↓ 溶液变红 因反应生成HCl溶于水使溶液显酸性
【解析】
CH4和Cl2光照生成CH3Cl(气体)、CH2Cl2、CHCl3、CCl4、HCl,随着反应进行,Cl2不断消耗,黄绿色逐渐消失,又由于生成的CH2Cl2、CHCl3、CCl4常温下均为无色液体,Cl2易溶于有机溶剂,使试管壁上有黄色油滴,故油状液滴可能是CH2Cl2、CHCl3、CCl4的混合物;因生成的HCl易溶于水,反应后,试管内气体压强减小,水位在试管内上升,HCl溶于水后,与AgNO3反应生成AgCl白色沉淀,同时溶液中溶质为HCl,故加入紫色石蕊试液后溶液变红。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】I.根据下表所示化学反应与数据关系,回答下列问题:
化学反应 | 平衡常数 | 温度 | |
973 K | 1173 K | ||
①Fe(s)+CO2(g)FeO(s)+CO(g) | K1 | 1.50 | 2.15 |
②Fe(s)+H2O(g)FeO(s)+H2(g) | K2 | 2.40 | 1.67 |
③CO(g)+H2O(g)CO2(g)+H2(g) | K3 | ? | ? |
(1)反应①是________(填“吸热”或“放热”)反应。
(2)在973K时,K3=_________。
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有______(填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.设法减小平衡体系中的CO浓度
Ⅱ.无机和有机氰化物在工农业生产中应用广泛,尤其是冶金工业常用的氰化物,含氰废水的处理显得尤为重要。含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。
(1)电解处理法:
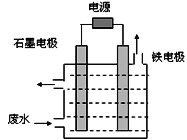
用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为__________(填“阴极” 或“阳极”),阳极产生ClO-的电极反应为__________________________,阳极产生的ClO-将CN-氧化为无害物质而除去的离子方程式为__________________________。
(2)UV(紫外光线的简称)—H2O2氧化法。
实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2,置于UV工艺装置中,
光照一定时间后取样分析。
【查阅资料】
①在强碱性溶液中4[Fe(CN)6]3-+4OH-===4[Fe(CN)6]4-+O2↑+2H2O,[Fe(CN)6]4-更稳定;
②[Fe(CN)6]3-转化为CN-容易被H2O2除去;
③HCN是有毒的弱酸,易挥发。
【问题设计】
①请写出HCN的电子式________________。
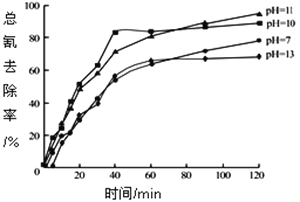
②含氰废水在不同pH下的除氰效果如图所示,pH选择的最佳范围应为________________(选填编号:![]() .7~10;
.7~10;![]() .10~11;
.10~11;![]() .11~13),解释该pH不宜太大的原因___________________。
.11~13),解释该pH不宜太大的原因___________________。
【题目】下表是元素周期表的一部分,根据要求回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
2 | E | H | F | I | ||||
3 | A | C | D | G | R | |||
4 | B |
(1)十种元素中化学性质最不活泼的元素是________(填元素符号)。
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是________(填化学式)。
(3)I元素跟A元素形成化合物的是_____(离子或共价)化合物。并用电子式表示该化合物的形成过程_____
(4)G的单质和B的最高价氧化物对应水化物反应的离子方程式是__________________。
(5)元素A和F能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式 ______________。