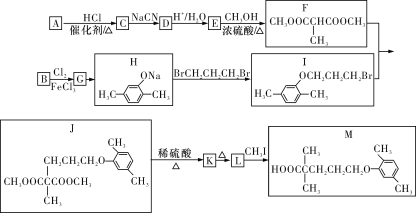
题目内容
【题目】下表是元素周期表的一部分,根据要求回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
2 | E | H | F | I | ||||
3 | A | C | D | G | R | |||
4 | B |
(1)十种元素中化学性质最不活泼的元素是________(填元素符号)。
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是________(填化学式)。
(3)I元素跟A元素形成化合物的是_____(离子或共价)化合物。并用电子式表示该化合物的形成过程_____
(4)G的单质和B的最高价氧化物对应水化物反应的离子方程式是__________________。
(5)元素A和F能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式 ______________。
【答案】Ar NaOH 离子 ![]() Cl2+2OH-=Cl-+ClO-+H2O 2Na2O2+2CO2=2Na2CO3+O2
Cl2+2OH-=Cl-+ClO-+H2O 2Na2O2+2CO2=2Na2CO3+O2
【解析】
根据元素在周期表中的位置可知,A为Na、B为K、C为Mg、D为Al、E为C、H为N、F为O、I为F、G为Cl、R为Ar,据此回答。
(1)稀有气体Ar原子最外层电子数为8,为稳定结构,化学性质最稳定,故答案为:Ar;
(2)同周期元素随着原子序数增大金属性逐渐减弱,则金属性Na>Mg>Al,金属性越强最高价氧化物对应的水化物的碱性越强,故NaOH的碱性最强,故答案为:NaOH;
(3)I元素跟A元素形成化合物为NaF,由钠离子与氟离子构成,为离子化合物,该化合物的形成过程用电子式表示为:![]() ,故答案为:离子;
,故答案为:离子;![]() ;
;
(4)G的单质为Cl2,B的最高价氧化物对应水化物为KOH,故反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)元素A 为Na,F为O,形成的两种化合物为Na2O、Na2O2,其中较稳定的化合物为Na2O2,Na2O2与CO2反应的方程式为:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2。

【题目】已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25 ℃) | Ka=1.8×10-5 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
请回答下列问题:
(1)25 ℃时,在某二元酸 H2A 溶液中存在的所有微粒为:H+、OH-、HA-、A2-、H2O,写出 H2A 的 电离方程式_____。
(2)25 ℃时,在 0.5 mol·L-1 的醋酸溶液中由醋酸电离出的[H+]约是_________,是该溶液 中由水电离出的[H+]的_____倍,醋酸的电离度为_____(填百分数)
(3)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:______________________________。
(4)25 ℃时,CH3COOH 与 CH3COONa 的混合溶液,若测得混合液 pH=6,则溶液中[CH3COO-]-[Na+]=_____(填准确数值)。
(5)25 ℃时,将 a mol·L-1 的醋酸与 b mol·L-1 氢氧化钠溶液等体积混合,反应后溶液恰好显中性, 用 a、b 表示醋酸的电离常数为_____。