题目内容
【题目】铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)═Fe(s)+CO2(g)△H1
Fe2O3(s)+![]() CO(g)═
CO(g)═![]() Fe3O4(s)+
Fe3O4(s)+![]() CO2(g)△H2
CO2(g)△H2
Fe3O4(s)+CO(g)═3Fe(s)+CO2(g)H3
Fe2O3(s)+CO(g)═2Fe(s)+3CO2(g)H4
则△H4的表达式为__________(用含△H1、△H2、△H3的代数式表示).
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
1600℃时固体物质的主要成分为__________,该温度下若测得固体混合物中m(Fe):m(O)=35:2,则FeO被CO还原为Fe的百分率为__________(设其它固体杂质中不含Fe、O元素).
(3)铁等金属可用作CO与氢气反应的催化剂.已知某种催化剂可用来催化反应CO(g)+3H2(g)CH4(g)+H2O(g)△H<0.在T℃,106Pa时将lmolCO和3molH2加入体积可变的密闭容器中.实验测得CO的体积分数x(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
①能判断CO(g)+3H2(g)![]() CH4(g)+H2O(g)达到平衡的是__________(填序号).
CH4(g)+H2O(g)达到平衡的是__________(填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO的转化率为__________;在T℃106Pa时该反应的压强平衡常数Kp(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)的计算式为__________;
③图表示该反应CO的平衡转化率与温度、压强的关系.图中温度T1、T2、T3由高到低的顺序是__________,理由是__________。

【答案】(1)△H2+![]() △H3 ;(2)FeO和Fe;80%;(3)①bd;②37.1%;
△H3 ;(2)FeO和Fe;80%;(3)①bd;②37.1%;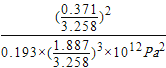 ;③T3>T2>T1;正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率升高
;③T3>T2>T1;正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率升高
【解析】
试题分析:(1)已知反应:Fe2O3(s)+![]() CO(g)═
CO(g)═![]() Fe3O4(s)+
Fe3O4(s)+![]() CO2(g)△H2 ②Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H3 ③,根据盖斯定律,将所给的反应②+③×
CO2(g)△H2 ②Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H3 ③,根据盖斯定律,将所给的反应②+③×![]() 可得:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),故△H4=△H2+
可得:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),故△H4=△H2+![]() △H3 ,故答案为:△H2+
△H3 ,故答案为:△H2+![]() △H3 ;
△H3 ;
(2)根据当1000℃时为FeO,在2000℃时为Fe,故在1600℃时固体物质的主要成分为FeO和Fe的混合物;设混合物中FeO的物质的量为xmol,Fe的物质的量为ymol,则有:![]() =
=![]() ,即可求的x:y=1:4,故剩余的FeO和被还原为铁的FeO的物质的量之比为1:4,则可知被还原的FeO的百分比为
,即可求的x:y=1:4,故剩余的FeO和被还原为铁的FeO的物质的量之比为1:4,则可知被还原的FeO的百分比为![]() ×100%=80%,故答案为:FeO和Fe;80%;
×100%=80%,故答案为:FeO和Fe;80%;
(3)①a.由于此容器是个体积可变的容器,故为恒容的容器,则容器内压强一直不变,故不能作为反应达平衡的标志,故a错误;b.此反应在平衡前,气体的质量不变,但体积变小,故密度变大,故当混合气体的密度不再发生变化时能说明反应达平衡,故b正确;c.反应达平衡的根本标志是v正=v逆,所以3v正(CO)=v逆(H2),故c错误;d.在反应达平衡之前,混合气体的质量不变,但物质的量变小,故混合气体的平均相对分子质量在变小,故当不变时能说明反应达平衡,故d正确。故选bd;
②设反应达平衡时CO转化了xmol,则根据三段式可知:
CO(g) + 3H2(g)![]() CH4(g)+H2O(g)
CH4(g)+H2O(g)
初始(n): 1mol 3mol 0 0
△n: xmol 3xmol xmol xmol
平衡(n): (1-x)mol (3-3x)mol xmol
结合平衡时CO的体积分数为0.193可知:![]() =0.193,解得x=0.371,故达到平衡时CO的转化率为=
=0.193,解得x=0.371,故达到平衡时CO的转化率为=![]() ×100%=37.1%;在T℃106Pa时该反应的压强平衡常数Kp=
×100%=37.1%;在T℃106Pa时该反应的压强平衡常数Kp=![]() =
=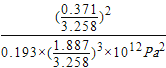 ,故答案为:37.1%;
,故答案为:37.1%;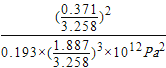 ;
;
③反应CO(g)+3H2(g)![]() CH4(g)+H2O(g)△H<0,温度越高,则平衡左移,CO的平衡转化率越低,根据图象可知,温度T3>T2>T1,故答案为:T3>T2>T1;正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率越高。
CH4(g)+H2O(g)△H<0,温度越高,则平衡左移,CO的平衡转化率越低,根据图象可知,温度T3>T2>T1,故答案为:T3>T2>T1;正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率越高。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25 ℃) | Ka=1.8×10-5 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
请回答下列问题:
(1)25 ℃时,在某二元酸 H2A 溶液中存在的所有微粒为:H+、OH-、HA-、A2-、H2O,写出 H2A 的 电离方程式_____。
(2)25 ℃时,在 0.5 mol·L-1 的醋酸溶液中由醋酸电离出的[H+]约是_________,是该溶液 中由水电离出的[H+]的_____倍,醋酸的电离度为_____(填百分数)
(3)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:______________________________。
(4)25 ℃时,CH3COOH 与 CH3COONa 的混合溶液,若测得混合液 pH=6,则溶液中[CH3COO-]-[Na+]=_____(填准确数值)。
(5)25 ℃时,将 a mol·L-1 的醋酸与 b mol·L-1 氢氧化钠溶液等体积混合,反应后溶液恰好显中性, 用 a、b 表示醋酸的电离常数为_____。