题目内容
【题目】某课外兴趣小组设计利用废旧干电池中的锌皮和未知浓度的稀盐酸制取纯净、干燥的氢气,并验证气体中是否含有杂质。实验装置图如图:
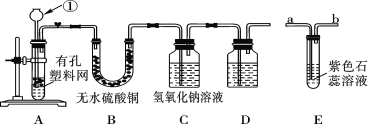
(1)装置A中仪器①的名称是_____;写出发生反应的离子反应方程式:_____。
(2)装置B中无水硫酸铜的作用是___。为了检验气体中还可能存在的杂质,可将E装置连接到上述装置___(填序号)之间。
(3)D装置中的试剂是_______(写出名称)。
(4)下列收集氢气的方法中符合题意的是_____。
A.排水法 B.向下排空气法 C.干瘪的塑料袋 D.塑料瓶
【答案】长颈漏斗 Zn+2H+=Zn2++H2↑ 检验氢气中混有水蒸气 BC 浓硫酸 C
【解析】
锌和盐酸反应生成氯化锌和氢气,用无水硫酸铜检验水,用紫色石蕊检验氢气中是否含有HCl杂质,用NaOH溶液除杂,再用浓硫酸干燥氢气,再收集氢气。
(1)装置A中仪器①的名称是长颈漏斗;锌和盐酸反应生成氯化锌和氢气,其反应的离子反应方程式:Zn+2H+=Zn2++H2↑;故答案为:长颈漏斗;Zn+2H+=Zn2++H2↑。
(2)装置B中无水硫酸铜的作用是检验氢气中混有水蒸气,为了检验气体中还可能存在的杂质,盐酸易挥发,因此主要是检验氢气中是否含有HCl,可将E装置连接到上述装置BC之间;故答案为:检验氢气中混有水蒸气;BC。
(3)C装置主要是除掉HCl,需要收集干燥的氢气,因此D装置主要干燥氢气,D中的试剂是浓硫酸;故答案为:浓硫酸。
(4)A.要收集干燥的氢气,因此不能用排水法收集,故A不符合题意;B.采用向下排空气法,收集到气体中含有杂质,氢气不纯,故B不符合题意;C.干瘪的塑料袋,能收集氢气,故C符合题意;D.塑料瓶不利于收集气体,故D不符合题意;综上所述,答案为C。

【题目】向硝酸酸化的2mL0.1molL-1AgNO3溶液(pH=2)中加入过量铁粉,振荡后静置,溶液先呈浅绿色,后逐渐呈粽黄色,试管底部仍存有黑色固体,过程中无气体生成。实验小组同学针对该实验现象进行如下探究。
Ⅰ.探究Fe2+产生的原因
(1)提出猜想:Fe2+可能是Fe与____或___反应的产物。
(2)实验探究:在两支试管中分别加入与上述实验等量的铁粉,再加入不同的液体试剂,5min后取上层清液,分别加入相同体积和浓度的铁氰化钾溶液
液体试剂 | 加人铁氰化钾溶液 | |
1号试管 | 2mL.0.1molL-1AgNO3溶液 | 无蓝色沉淀 |
2号试管 | ______ | 蓝色沉淀 |
①2号试管中所用的试剂为____。
②资料显示:该温度下,0.1molL-1的AgNO3溶液可以将Fe氧化为Fe2+。但1号试管中未观察到蓝色沉淀的原因可能为____。
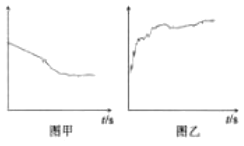
③小组同学继续进行实验,证明了2号试管得出的结论正确。实验如下:取100mL0.1molL-1硝酸酸化的AgNO3溶液(pH=2),加入铁粉井搅拌,分别插入pH传感器和NO3-传感器(传感器可检测离子浓度),得到如图图示,其中pH传感器测得的图示为___(填“图甲”或“图乙”)。
④实验测得2号试管中有NH4+生成,则2号试管中发生反应的离子方程式为___。
Ⅱ.探究Fe3+产生的原因
查阅资料可知,反应中溶液逐渐变棕黄色是因为Fe2+被Ag+氧化。小组同学设计不同实验方案对此进行验证。
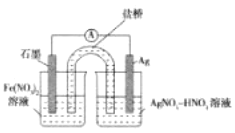
(3)方案一;取出少量黑色固体,洗涤后___(填操作和现象),证明黑色固体中有Ag。
(4)方案二:按图连接装置,一段时间后取出左侧烧杯溶液,加人KSCN溶液,溶液变F红。该实验现象____(填“能“或“不能“)证明Fe2+可被Ag+氧化,理由为__。