题目内容
【题目】铝粉与氧化铁的混合物叫做铝热剂,发生的反应称为铝热反应:2Al+Fe2O3→2Fe+Al 2O3,可用于焊接铁轨。完成下列计算:
(1)若铝热剂中铝粉和氧化铁恰好完全反应,则该铝热剂中铝的质量分数为___。(精确到0.001)
(2)将8.1g铝粉与16g氧化铁混合后充分反应,最多可制得铁___g;将反应后的固体混合物加入足量的稀盐酸中,充分反应后最多可生成氢气____mol。
(3)23.52g某铝热剂在隔绝空气的条件下充分反应后,将固体溶解于200 mL5 mol/L的盐酸中,完全溶解后溶液中c(H+)=0.2mol/L(溶液体积变化忽略不计),且无Fe3+。计算该铝热剂中铝粉与氧化铁的物质的量分别是多少?___、___。
(4)取某铝热剂反应后的固体,滴加4mol/L的NaOH溶液,当加至30mL时固体质量不再减小,且剩余固体质量为7.2g,并收集到672 mL的氢气(标准状况)。计算原铝热剂中氧化铁的质量分数为多少?(精确到0.001)____
【答案】0.252或25.2% 11.2 0.35 0.16mol 0.12mol 76%
【解析】
(1)若铝热剂中铝粉和氧化铁恰好完全反应,2Al+Fe2O3→2Fe+Al 2O3,则铝与氧化铁的物质的量之比2:1,据此计算;
(2)计算铝粉和氧化铁的物质的量,再根据方程式计算;
(3)利用守恒法计算;
(4)根据Al2O3+2NaOH=2NaAlO2+H2O;2Al+2NaOH+2H2O=2NaAlO2+3H2↑计算。
(1)根据方程式2Al+Fe2O3→2Fe+Al 2O3,若铝热剂中铝粉和氧化铁恰好完全反应,则铝粉与氧化铁物质的量之比2:1混合,铝的质量分数为![]() =0.252或25.2%;
=0.252或25.2%;
答案:0.252或25.2%;
(2)n(Al)=![]() =0.3mol,n(Fe2O3)=
=0.3mol,n(Fe2O3)=![]() =0.1mol;
=0.1mol;
2Al+ Fe2O3→ 2Fe+ Al 2O3
2mol 1mol 2mol 1mol
0.3mol 0.1mol n(Fe)
得铝粉过量0.3mol-0.2mol=0.1mol n(Fe)=0.2mol m(Fe)=0.2mol×56g/mol=11.2g;
2Al+6HCl=2AlCl3+3H2↑
2mol 3mol
0.1mol 0.15mol
Fe+2HCl=FeCl2+H2↑
1mol 1mol
0.2mol 0.2mol
得氢气n(H2)=0.15mol+0.2mol=0.35mol;
答案:11.2 0.35;
(3)反应后的溶液中没有Fe3+,说明恰好完全反应或者是铝粉过量。设铝粉物质的量为xmol,氧化铁为ymol;
根据总质量列方程:27x+160y=23.52g ①
根据最终反应后的溶液中,电荷守恒列方程式:3x+2y×2+0.2mol/L×0.2L=5mol/L×0.2L ②
由①②联立可得:x=0.16mol、y=0.12mol;
答案:0.16mol 0.12mol;
(4)反应后的固体加入NaOH中有气体生成,说明反应后的固体中有Al,则氧化物没有剩余,则与NaOH反应剩余的固体是铁。铝和氢氧化钠溶液反应生成n(H2)=![]() =0.3mol,4mol/L的NaOH溶液,当加至30mL氢氧化钠的物质的量为:0.12mol,根据2Al+2NaOH+2H2O=2NaAlO2+3H2↑,Al2O3+2NaOH=2NaAlO2+H2O的关系式知,原铝热剂中铝的总物质的量为:0.12mol;剩余7.2g为Fe,Fe2O3的质量为
=0.3mol,4mol/L的NaOH溶液,当加至30mL氢氧化钠的物质的量为:0.12mol,根据2Al+2NaOH+2H2O=2NaAlO2+3H2↑,Al2O3+2NaOH=2NaAlO2+H2O的关系式知,原铝热剂中铝的总物质的量为:0.12mol;剩余7.2g为Fe,Fe2O3的质量为![]() 10.29g,计算原铝热剂中氧化铁的质量分数为
10.29g,计算原铝热剂中氧化铁的质量分数为![]() =76%;
=76%;
答案:76%。

【题目】某化学反应2A![]() B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验 序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10至20分钟内A的平均速率为____________。
(2)在实验2中,A的初始浓度=_____,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是____。
(3)设实验3中的反应速率为v3,实验1的反应速率为v1,则v3______v1(填“>”、“=”或“<”),且C3___1.0mol/L(填“<”、“=”或“>”)。
(4)比较实验4和实验1,可推测该反应是____反应(填“吸热”或“放热”)。
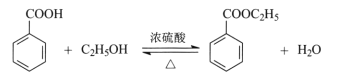
【题目】苯甲酸乙酯可由苯甲酸与乙醇在浓硫酸共热下反应制得,反应装置如图(部分装置省略),反应原理如下:
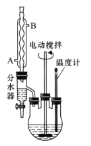
实验操作步骤:
①向三颈烧瓶内加入12.2g苯甲酸、25mL乙醇、20mL苯及4mL浓硫酸,摇匀,加入沸石。
②装上分水器、电动搅拌器和温度计,加热至分水器下层液体接近支管时将下层液体放入量筒中。继续蒸馏,蒸出过量的乙醇,至瓶内有白烟(约3h),停止加热。
③将反应液倒入盛有80mL冷水的烧杯中,在搅拌下分批加入碳酸钠粉末至溶液无二氧化碳逸出,用pH试纸检验至呈中性。
④用分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层。用无水CaC12干燥,粗产物进行蒸馏,低温蒸出乙醚。当温度超过140℃时,直接接收210-213℃的馏分,最终通过蒸馏得到纯净苯甲酸乙酯12.8mL。
可能用到的有关数据如下:
相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
苯甲酸 | 122 | 1.27 | 249 | 微溶于水,易溶于乙醇、乙醚 |
苯甲酸乙酯 | 150 | 1.05 | 211-213 | 微溶于热水,溶于乙醇、乙醚 |
乙醇 | 46 | 0.79 | 78.5 | 易溶于水 |
乙醚 | 74 | 0.73 | 34.5 | 微溶于水 |
回答以下问题:
(1)反应装置中分水器上方的仪器名称是______,其作用是____
(2)步骤①中加浓硫酸的作用是_________,加沸石的目的是______。
(3)步骤②中使用分水器除水的目的是_________。
(4)步骤③中加入碳酸钠的目的是________ 。
(5)步骤④中有机层从分液漏斗的____(选填“上口倒出”或“下口放出”)。
(6)本实验所得到的苯甲酸乙酯产率是________%。