题目内容
【题目】(1)写出下列物质在水溶液中的电离方程式。
①CH3COOH _________ ② NaHSO4 __________________
(2)某温度下,纯水中的c(H+)=2×10-7 mol/L,则此时c(OH-)=______。若温度不变,滴入稀硫酸使c(H+)=5×10-6 mol/L,则由水电离出的c(H+)为_______ 。
(3)常温下,浓度均为0.01 mol/L 的两瓶溶液盐酸和氢氟酸,升高相同的温度,c(Cl-)/ c(F-)的值__________(填“变大”“变小”“不变”)。
【答案】CH3COOHCH3COO-+H+ NaHSO4=Na++H++SO42- 2×10-7mol·L-1 8×10-9mol·L-1 变小
【解析】
(1)醋酸在溶液中部分电离,硫酸氢钠在溶液中完全电离,以此解答;
(2)纯水中c(H+)=c(OH-),则c(OH-)=2×10-7mol·L-1;由于c(H+)=c(OH-)=2×10-7mol·L-1,则Kw=4×10-14,加入盐酸后,c(OH-)=![]() mol·L-1=8×10-9mol·L-1;水电离出的氢离子浓度c(H+)=c(OH-);
mol·L-1=8×10-9mol·L-1;水电离出的氢离子浓度c(H+)=c(OH-);
(3)HCl是强酸,升高温度不影响c(Cl-)的浓度,氢氟酸是弱酸,升高温度电离程度增加,c(F-)升高。
(1)醋酸在溶液中部分电离,其电离方程式为:CH3COOHCH3COO-+H+,故答案为:CH3COOHCH3COO-+H+;硫酸氢钠在溶液中完全电离,其电离方程式为:NaHSO4=Na++H++SO42-,故答案为:NaHSO4=Na++H++SO42-。
(2)纯水中c(H+)=c(OH-),则c(OH-)=2×10-7mol·L-1;由于c(H+)=c(OH-)=2×10-7mol·L-1,则Kw=4×10-14,加入盐酸后,c(OH-)=![]() mol·L-1=8×10-9mol·L-1;水电离出的氢离子浓度c(H+)=c(OH-)= 8×10-9mol·L-1;
mol·L-1=8×10-9mol·L-1;水电离出的氢离子浓度c(H+)=c(OH-)= 8×10-9mol·L-1;
(3)HCl是强酸,升高温度不影响c(Cl-)的浓度,氢氟酸是弱酸,升高温度电离程度增加,c(F-)升高,故c(Cl-)/ c(F-)的值变小。

【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
【题目】甲胺![]() 是合成太阳能敏化剂的原料。一定温度下,在三个体积均为
是合成太阳能敏化剂的原料。一定温度下,在三个体积均为![]() 的恒容密闭容器中按不同方式投入反应物,发生反应
的恒容密闭容器中按不同方式投入反应物,发生反应![]() ,测得有关实验数据如表,下列说法正确的是
,测得有关实验数据如表,下列说法正确的是
容器编号 | 温度 | 起始物质的量 | 平衡时物质的量 | ||||
|
|
|
| CH3NH2(g) |
| ||
Ⅰ | 530 |
|
| 0 | 0 |
| |
Ⅱ | 530 |
|
| 0 | 0 | ||
Ⅲ | 500 | 0 | 0 |
|
|
| |
A.达到平衡时,体系中![]() 关系:
关系:![]() ,Ⅰ
,Ⅰ![]() ,Ⅱ
,Ⅱ![]()
B.达到平衡时,转化率:![]() ,Ⅲ
,Ⅲ![]()
C.正反应的平衡常数![]() Ⅰ
Ⅰ![]() Ⅱ
Ⅱ![]() Ⅲ
Ⅲ![]()
D.530K时,若起始向容器Ⅰ中充入![]()
![]() 、
、![]() 、
、![]() 、
、![]()
![]() ,则反应将向逆反应方向进行
,则反应将向逆反应方向进行
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
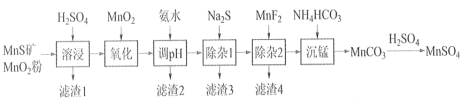
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的 pH 范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的 pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的 pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“溶浸”中二氧化锰与硫化锰可以发生氧化还原反应,推测“滤渣1”含有___________ 和SiO2;
(2)“调pH”除铁和铝,溶液的pH范围应调节范围是________________之间。
(3)“除杂1”的目的是除去Zn2+和Ni2+,写出除Zn2+的方程式:__________________。
(4)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高对沉淀Mg2+完全的影响是__________________(有利、不利、无影响)。
(5)在溶浸前,先把矿石研磨成粉末的原因:_______________________。