题目内容
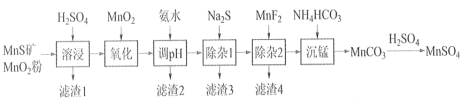
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的 pH 范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的 pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的 pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“溶浸”中二氧化锰与硫化锰可以发生氧化还原反应,推测“滤渣1”含有___________ 和SiO2;
(2)“调pH”除铁和铝,溶液的pH范围应调节范围是________________之间。
(3)“除杂1”的目的是除去Zn2+和Ni2+,写出除Zn2+的方程式:__________________。
(4)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高对沉淀Mg2+完全的影响是__________________(有利、不利、无影响)。
(5)在溶浸前,先把矿石研磨成粉末的原因:_______________________。
【答案】S 4.7~6 Zn2++S2-=ZnS↓ 不利 增大接触面积,加快反应速率,提高浸取率
【解析】
流程:二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)在硫酸中酸浸,主要的反应为:MnO2+MnS+2H2SO4=2MnSO4+S+2H2O,SiO2不溶于硫酸,过滤,滤渣1含有S和SiO2,滤液含有Mn2+、Fe2+、Fe3+、Al3+、Mg2+、Zn2+、Ni2+,加入MnO2将Fe2+氧化为Fe3+,加入氨水调节pH4.7~6之间,除去Fe3+、Al3+,滤渣2为Fe(OH)3、Al(OH)3,滤液中加入Na2S除去Zn2+和Ni2+,“滤渣3”的主要成分是NiS和ZnS,加入MnF2生成MgF2沉淀除去Mg2+,滤渣4为MgF2,滤液主要含有Mn2+,加入碳酸氢铵发生反应:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,用硫酸溶解碳酸锰得到产品硫酸锰。
(1)“溶浸”中二氧化锰与硫化锰可以发生氧化还原反应,“溶浸”中二氧化锰与硫化锰反应为:MnO2+MnS+2H2SO4=2MnSO4+S+2H2O,推测“滤渣1”含有S和SiO2;故答案为:S;
(2)调节pH的目的是除去Fe3+、Al3+,但不沉淀Mn2+、Mg2+、Zn2+、Ni2+,根据表pH的范围为4.7~6;故答案为:4.7~6;
(3)“除杂1”的目的是除去Zn2+和Ni2+,采用加入Na2S除去Zn2+和Ni2+,“滤渣3”的主要成分是NiS和ZnS,除Zn2+的方程式:Zn2++S2-=ZnS↓。故答案为:Zn2++S2-=ZnS↓;
(4)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高对沉淀Mg2+完全的影响是Mg2+沉淀不完全,因为F-与H+结合形成弱电解质HF,MgF2![]() Mg2++2F-平衡向右移动;故答案为:不利;
Mg2++2F-平衡向右移动;故答案为:不利;
(5)在溶浸前,先把矿石研磨成粉末的原因:增大接触面积,加快反应速率,提高浸取率。故答案为:增大接触面积,加快反应速率,提高浸取率。