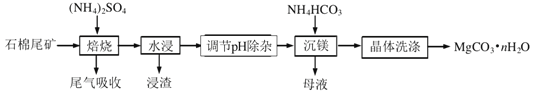
题目内容
【题目】常温下,向100 mL 0.2 mol·L-1的氨水中逐滴加入0.2 mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。

根据图象回答下列问题。
(1)表示NH3·H2O浓度变化的曲线是_____(填“A”或“B”)。
(2)NH3·H2O的电离常数为_____。
(3)当加入盐酸体积为50 mL时,溶液中c(NH4+)-c(NH3·H2O)=___ mol·L-1(用数字表示)。
【答案】A 1.8×10—5(或10—4.74) 2×10—5-2×10-9
【解析】
(1)题干信息可知向100mL 0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,一水合氨浓度减小,据此分析;
(2)一水合氨电离平衡常数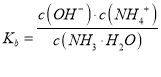 ,平衡常数只随温度变化,取pH=9.26时的浓度计算,此时c(NH4+)=c(NH3H2O),据此分析;
,平衡常数只随温度变化,取pH=9.26时的浓度计算,此时c(NH4+)=c(NH3H2O),据此分析;
(3)依据电荷守恒和物料守恒分析;
(1)常温下向100mL 0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,一水合氨浓度减小,表示NH3H2O浓度变化的曲线是A,
故答案为:A;
(2) NH3H2O的电离常数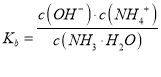 ,平衡常数只随温度变化,取pH=9.26时的浓度计算,此时c(NH4+)=c(NH3H2O),
,平衡常数只随温度变化,取pH=9.26时的浓度计算,此时c(NH4+)=c(NH3H2O),![]() ,
,![]() ,故答案为:1.8×105或104.74;
,故答案为:1.8×105或104.74;
(3)当加入盐酸体积为50mL时,此时溶液pH=9,溶液中存在等浓度的一水合氨、氯化铵,溶液中存在电荷守恒c(NH4+)+c(H+)=c(Cl)+c(OH)和物料守恒得到c(NH4+)+c(NH3·H2O)=2c(Cl),得到c(NH4+)-c(NH3·H2O)=2c(OH)2c(H+)=2×1052×109,
故答案为:2×1052×109。

【题目】催化技术可处理汽车尾气:![]() ,某温度下在容积不变的密闭容器中通入NO和CO,不同时间NO和CO的浓度如下表.下列说法中不正确的是
,某温度下在容积不变的密闭容器中通入NO和CO,不同时间NO和CO的浓度如下表.下列说法中不正确的是
时间 | 0 | 1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A.2s内的平均反应速率![]()
![]()
B.在该温度下![]()
C.若将容积缩小为原来的一半,NO转化率大于![]()
D.某时刻再充入![]() molNO,
molNO,![]() molCO,重新达平衡后CO浓度比原平衡大
molCO,重新达平衡后CO浓度比原平衡大