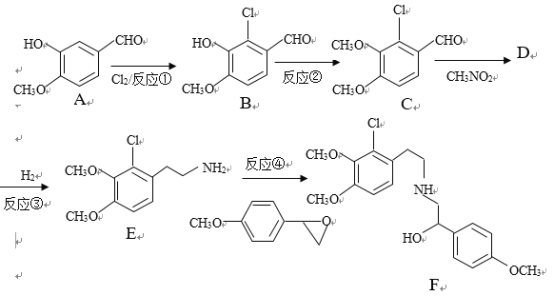
题目内容
【题目】碳酸钠有两种化合物,碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3),其中碳酸钠最为重要,在工业上有广泛的应用。在生活中,碳酸氢钠是常用的发酵剂的主要成分。完成下列计算:
(1)某天然碱的化学组成可能为aNa2CO3bNaHCO3cH2O(a、b、c为正整数),为了确定其成分:称取天然碱样品7.3g,充分加热后得到水的质量为0.9g,二氧化碳的质量为1.1g。该天然碱的化学式为____________。
(2)为了测定某发酵剂样品中碳酸氢钠的含量,取样品n克,充分灼烧以后,称的残留固体质量为m克(假设其他成分不分解)。则样品中碳酸氢钠的质量:_________(填含n、m的计算式)。
(3)已知酸性强弱顺序为:H2CO3 > HCO3- > HX。取由0.4molNaX、0.2molNa2CO3和0.1molNaHCO3组成的混合物,溶于200mL水中,往所得溶液中通入一定量的CO2气体,反应明显分两步,完成下列表格。
CO2(mol) | 0.05 | 0.15 | 0.6 |
NaX(mol) | ____ | ____ | ____ |
Na2CO3(mol) | ____ | ____ | ____ |
NaHCO3(mol) | ____ | ____ | ____ |
【答案】Na2CO32NaHCO3H2O 84(n—m)/31 0.2 0 0 0.35 0.45 0 0 0 0.9
【解析】
2NaHCO3![]() NaCO3+H2O+CO2↑,二氧化碳的质量为1.1g,则n(NaHCO3)=
NaCO3+H2O+CO2↑,二氧化碳的质量为1.1g,则n(NaHCO3)=![]() ,充分加热后得到水的质量为0.9g,碳酸氢钠分解会生成水,同时化合物中有结晶水,则化合物中水为
,充分加热后得到水的质量为0.9g,碳酸氢钠分解会生成水,同时化合物中有结晶水,则化合物中水为![]() ,天然碱晶体中n(Na2CO3)=
,天然碱晶体中n(Na2CO3)=![]() ,则n(Na2CO3):n(NaHCO3):n(H2O)=0.025mol:0.05mol:0.025mol=1:2:1;结合2NaHCO3
,则n(Na2CO3):n(NaHCO3):n(H2O)=0.025mol:0.05mol:0.025mol=1:2:1;结合2NaHCO3![]() Na2CO3+H2O+CO2↑及差量法计算;酸性强弱顺序为:H2CO3>HCO3->HX,未通CO2时,NaX与NaHCO3发生反应NaX+ NaHCO3=Na2CO3+HX;通入CO2先发生反应2NaX+CO2+H2O=2HX+Na2CO3,再与Na2CO3反应,反应为Na2CO3+CO2+H2O=2NaHCO3,结合方程式计算。据此分析。
Na2CO3+H2O+CO2↑及差量法计算;酸性强弱顺序为:H2CO3>HCO3->HX,未通CO2时,NaX与NaHCO3发生反应NaX+ NaHCO3=Na2CO3+HX;通入CO2先发生反应2NaX+CO2+H2O=2HX+Na2CO3,再与Na2CO3反应,反应为Na2CO3+CO2+H2O=2NaHCO3,结合方程式计算。据此分析。
(1)根据以上分析n(Na2CO3):n(NaHCO3):n(H2O)=0.025mol:0.05mol:0.025mol=1:2:1,则天然碱的化学组成可能为Na2CO32NaHCO3H2O;答案为:Na2CO32NaHCO3H2O;
(2)取样品n克,充分灼烧以后,称的残留固体质量为m克,设碳酸氢钠为xg, ,
, ![]() ,故答案为:
,故答案为:![]() ;
;
(3)酸性强弱顺序为:H2CO3>HCO3->HX,未通CO2时,NaX与NaHCO3发生反应NaX+ NaHCO3=Na2CO3+HX;通入CO2先发生反应2NaX+CO2+H2O=2HX+Na2CO3,再与Na2CO3反应,反应为Na2CO3+CO2+H2O=2NaHCO3;0.1molNaX与NaHCO3发生反应生成0.1mol Na2CO3,当通入0.05molCO2时,NaX反应消耗0.1mol,生成0.05molNa2CO3,此时,溶液中还有0.2molNaX,0.35mol Na2CO3,0mol NaHCO3;同理可得,继续通入0.1molCO2时,发生反应2NaX+CO2+H2O=2HX+Na2CO3,NaX反应消耗0.2mol,生成0.1molNa2CO3,此时,溶液中还有0molNaX,0.45molNa2CO3,0molNaHCO3;继续通入0.45molCO2时,与溶液中的0.45molNa2CO3恰好完全反应,同时生成0.45molNaHCO3,所以此时溶液中0molNaX,0molNa2CO3,0.9mol NaHCO3;答案为:
CO2(mol) | 0.05 | 0.15 | 0.6 |
NaX(mol) | 0.2 | 0 | 0 |
Na2CO3(mol) | 0.35 | 0.45 | 0 |
NaHCO3(mol) | 0 | 0 | 0.9 |