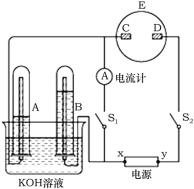
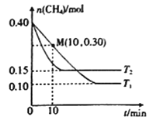
题目内容
【题目】常温下,在溶液中可发生以下反应:①![]() ②
②![]() ③
③![]() 由此判断下列说法正确的是()
由此判断下列说法正确的是()
A.铁元素在反应①中被还原,在③中被氧化
B.反应②中当有1molCl2被氧化时,有2molBr—被还原
C.氧化性强弱顺序为:![]()
D.还原性强弱顺序为:![]()
【答案】D
【解析】
A、①2Fe2++Br2=2Fe3++2Br-中Fe失电子被氧化,③2Fe3++2I-=2Fe2++I2中Fe得电子被还原,A错误;
B、反应中Cl的化合价降低,Br的化合价升高,则有1molCl2被还原,就有2molBr-被氧化,B错误;
C、①2Fe2++Br2=2Fe3++2Br-中Br2的氧化性大于Fe3+,②2Br-+Cl2=Br2+2Cl-中Cl2的氧化性大于Br2,③2Fe3++2I-=2Fe2++I2中Fe3+的氧化性大于I2,所以氧化性大小顺序为:Cl2>Br2>Fe3+>I2,C错误;
D、①2Fe2++Br2=2Fe3++2Br-中还原性Fe2+>Br-,②2Br-+Cl2=Br2+2Cl-中的还原性Br->Cl-,③2Fe3++2I-=2Fe2++I2中的还原性I->Fe2+,所以还原性大小顺序为:I->Fe2+>Br->Cl-,D正确;
答案选D。

 目标测试系列答案
目标测试系列答案【题目】氢能的存储是氢能应用的主要瓶颈,开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①基态Ti2+中含有的电子数为______,电子占据的最高能级是______,该能级具有的原子轨道数为______。
②BH4-中B原子的杂化方式是______。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______ H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 | I4/kJmol-1 | I5/kJmol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
该氢化物的化学式为______。
(3)液氨是富氢物质,是氢能的理想载体。
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是 ______。
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,该化合物的结构式为 ______。
(4)2008年,Yoon等人发现Ca与C60(分子结构如图1)生成的Ca32C60能大量吸附H2分子。
①C60晶体易溶于苯、CS2,C60是 ______ 分子(填“极性”或“非极性”)。
②1mol C60分子中,含有σ 键数目为 ______ 个(阿伏加德罗常数用NA表示)。
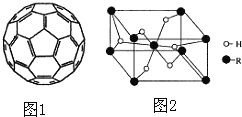
(5)某金属氢化物储氢材料的晶胞结构如图2所示,该金属氢化物的化学式为 ______,已知该晶体的密度为agcm-3,金属元素R的相对原子质量为M,阿伏加德罗常数为NA,则该晶胞的体积为 ______ cm3。