题目内容
16.写出下列物质形成过程的电子式以及所含化学键类型(离子键、极性键、非极性键).(1)Cl2
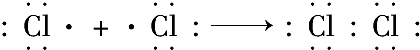 含有非极性键
含有非极性键(2)HClH•+
 →
→ 含有极性键键
含有极性键键(3)MgCl2
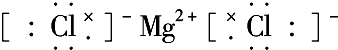 含有离子键
含有离子键(4)H2O2
 含有极性键、非极性键
含有极性键、非极性键(5)NaOH
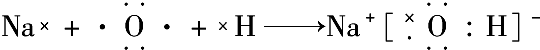 含有离子键、极性键.
含有离子键、极性键.
分析 书写电子式时注意离子化合物和共价化合物、单质的区别以及核外最外层电子数目,
(1)氯气为非金属单质,含有非极性键;
(2)氯化氢为共价化合物,含有极性键;
(3)氯化镁为离子化合物,含有离子键;
(4)过氧化氢为共价化合物,含有极性键和非极性键;
(5)氢氧化钠为离子化合物,含有离子键和极性键.
解答 解:(1)氯气为非金属单质,含有非极性键,用电子表示形成过程为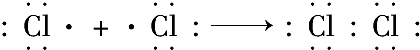 ,
,
故答案为: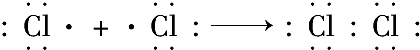 ; 非极性;
; 非极性;
(2)HCl是氢原子和氯原子通过共价键形成的极性分子,其形成过程是:H•+ →
→ ,含有极性键,
,含有极性键,
故答案为:H•+ →
→ ;
;
(3)氯化镁为离子化合物,含有离子键,用电子表示形成过程为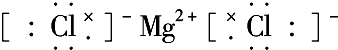 ,
,
故答案为: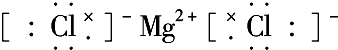 ; 离子;
; 离子;
(4)过氧化氢为共价化合物,用电子表示形成过程为 ,含有极性键和非极性键,
,含有极性键和非极性键,
故答案为: ;极性键、非极性;
;极性键、非极性;
(5)氢氧化钠为离子化合物,含有离子键和极性键,用电子表示形成过程为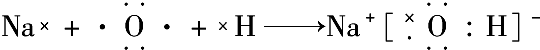 ,
,
故答案为: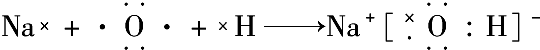 ;离子键、极性.
;离子键、极性.
点评 本题考查了电子式的书写,题目难度不大,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法.

练习册系列答案
相关题目
6.元素砹(At)原子序数为85,下面关于该元素说法不正确的是( )
| A. | AgAt 不溶于水 | |
| B. | HAt很不稳定 | |
| C. | At的单质是白色固体 | |
| D. | 该元素位于元素周期表第六周期、第十七列 |
7.下列有关化学用语正确的是( )
| A. | 氯化氢分子的电子式: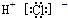 | |
| B. | H2O的结构式:H-O-H | |
| C. | 硫原子的结构示意图: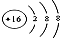 | |
| D. | 原子核内有8个中子的氧原子:${\;}_{8}^{18}$O |
4. 如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
 如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A. | 外电路的电流方向为:X→外电路→Y | |
| B. | 若两电极分别为 Fe 和碳棒,则 X 为碳棒,Y 为 Fe | |
| C. | X 极上发生的是还原反应,Y 极上发生的是氧化反应 | |
| D. | 若两电极都是金属,则它们的活动性顺序为 X>Y |
8.下列说法或计算正确的是( )
| A. | 采用加热蒸发溶剂的方法可以使浓度为4 mol/L的盐酸溶液的浓度变为8 mol/L | |
| B. | 把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10% | |
| C. | 将2.3 g Na投入到97.7g水中充分反应,所得溶液的质量分数为4.0% | |
| D. | 已知某温度下KNO3的溶解度是31.6 g,该温度下将20 g KNO3溶解于50 g水中,充分溶解,获得溶液的质量分数是28.6% |
6.元素X的原子获得3个电子或Y的原子失去了2个电子后,它们的电子层结构与氖原子的电子层结构相同,X、Y两种元素的单质在高温下反应产物的化学式为( )
| A. | Y3X2 | B. | X2Y3 | C. | X3Y3 | D. | Y2X3 |
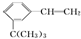 有如下性质:
有如下性质: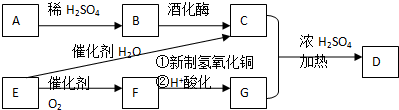
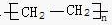 .
.