题目内容
2.实验室制取氯气可以有以下途径,用化学方程式表示如下.若制取等质量的氯气,消耗盐酸最少的是( )| A. | 8HCl+K2Cr2O7$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+Cr2O3+3Cl2↑+4H2O | |
| B. | 16HCl+2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$2MnCl2+2KCl+5Cl2↑+8H2O | |
| C. | 4HCl+MnO2═MnCl2+Cl2↑+2H2O | |
| D. | 6HCl+KClO3═KCl+3Cl2↑+3H2O |
分析 由方程式找出氯化氢与氯气的量的关系,计算生成1mol氯气消耗的HCl的物质的量,
A.反应中存在定量关系:8HCl~Cl2;
B.反应中存在定量关系:$\frac{16}{5}$HCl~Cl2;
C.存在4HCl~Cl2 ;
D.反应中存在定量关系:2HCl~Cl2 .
解答 解:A.8HCl+K2Cr2O7$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+Cr2O3+3Cl2↑+4H2O,生成1mol氯气消耗8molHCl;
B.16HCl+2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$2MnCl2+2KCl+5Cl2↑+8H2O,生成1mol氯气消耗$\frac{16}{5}$molHCl;
C.4HCl+MnO2═MnCl2+Cl2↑+2H2O,生成1mol氯气消耗4molHCl;
D.6HCl+KClO3═KCl+3Cl2↑+3H2O,生成1mol氯气消耗2molHCl;
综上所述:D消耗氯化氢最少,
故选:D.
点评 本题考查了化学方程式的计算,准确把握方程式中物质的定量关系是解题关键,题目难度不大.

练习册系列答案
相关题目
12.在一定条件下,对于A2(g)+3B2(g)?2AB3(g)反应来说,下列所表示的化学反应速率中最大的是( )
| A. | v(A2)=0.8 mol/(L•s) | B. | v(A2)=60 mol/(L•min) | ||
| C. | v(AB3)=1.0 mol/(L•s) | D. | v(B2)=1.2 mol/(L•s) |
13.有不纯的CuCl2 1.35g,与足量的AgNO3溶液反应,可生成2.9g沉淀,则该氯化铜中所含的杂质可能是下列中的( )
| A. | ZnCl2 | B. | KCl | C. | NaCl | D. | BaCl2 |
17.某元素原子核外第二层是其他层电子数之和的2倍,则该元素的核电荷数为( )
| A. | 4 | B. | 8 | C. | 12 | D. | 16 |
7.将Cl2通入下列溶液中,溶质不发生化学变化的是( )
| A. | Na2CO3 | B. | AgNO3 | C. | NaOH | D. | KNO3 |
11.电解CuSO4溶液时,若要达到以下三个要求:①阳极质量减少;②阴极质量增加; ③电解溶液中c(Cu2+)不变,则可选用的电极是( )
| A. | 纯铜作阳极,含Zn、Ag的Cu合金作阴极 | |
| B. | 含Zn、Ag的Cu合金作阳极,纯铜作阴极 | |
| C. | 用纯铁作阳极,纯铜作阴极 | |
| D. | 用石墨作阳极,用惰性电极(Pt)作阴极 |
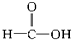 羧酸②
羧酸②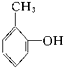 酚③
酚③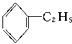 芳香烃④
芳香烃④ 羧酸⑤
羧酸⑤ 酯.
酯.