题目内容
11.电解CuSO4溶液时,若要达到以下三个要求:①阳极质量减少;②阴极质量增加; ③电解溶液中c(Cu2+)不变,则可选用的电极是( )| A. | 纯铜作阳极,含Zn、Ag的Cu合金作阴极 | |
| B. | 含Zn、Ag的Cu合金作阳极,纯铜作阴极 | |
| C. | 用纯铁作阳极,纯铜作阴极 | |
| D. | 用石墨作阳极,用惰性电极(Pt)作阴极 |
分析 电解CuSO4溶液时,若要求达到以下三点要求:①阳极质量减小、②阴极质量增加、③电解质溶液中Cu2+浓度不变,说明该装置为电镀池且阳极为Cu,据此分析解答;
解答 解:电解CuSO4溶液时,若要求达到以下三点要求:①阳极质量减小、②阴极质量增加、③电解质溶液中Cu2+浓度不变,说明该装置为电镀池且阳极为Cu,
A.纯铜作阳极,含Zn、Ag的铜合金作阴极,符合题干信息,故A正确;
B.含Zn、Ag的铜合金作阳极、纯铜作阴极时,阳极质量减少、阴极质量增加,且电解质溶液中铜离子浓度降低,故B错误;
C.用纯铁作阳极,用纯铜作阴极,阴极上铜离子放电,所以电解质溶液中铜离子浓度降低,故C错误;
D.用石墨作阳极,用惰性电极(Pt)作阴极,阳极质量不变、电解质溶液中铜离子浓度降低,故D错误;
故选:A;
点评 本题考查了电解原理,根据题干信息确定阴阳极材料,再结合选项分析解答,注意:活泼金属作阳极时,阳极上金属失电子,为易错点.

练习册系列答案
相关题目
2.实验室制取氯气可以有以下途径,用化学方程式表示如下.若制取等质量的氯气,消耗盐酸最少的是( )
| A. | 8HCl+K2Cr2O7$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+Cr2O3+3Cl2↑+4H2O | |
| B. | 16HCl+2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$2MnCl2+2KCl+5Cl2↑+8H2O | |
| C. | 4HCl+MnO2═MnCl2+Cl2↑+2H2O | |
| D. | 6HCl+KClO3═KCl+3Cl2↑+3H2O |
6.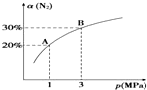 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )| A. | 将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ | |
| B. | 平衡状态由A变到B时,平衡常数K(A)<K(B) | |
| C. | 上述反应在达到平衡后,增大压强,H2的转化率增大 | |
| D. | 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小 |
20.化合物YZ2、ZX2中,X、Y、Z都是前三周期的元素,X与Y属于同一周期,Z是X的同族元素,Z元素核内有16个质子,Y元素最外层电子数是K层所能容纳的电子数的2倍,则YX2和ZX2各为什么物质?
1.某溶液中可能含有Na+、NH4+、Ba2+、Br-、CO32-、I-、SO32-.某兴趣小组为确定该溶液的组成,进行了下列实验:取样,滴加足量氯水,有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉均无明显变化.下列说法正确的是( )
| A. | 溶液中一定存在Na+、I-、CO32- | |
| B. | 溶液中一定不存在的只有I-、SO32- | |
| C. | 只需再进行一个实验,就可完全确定溶液的组成 | |
| D. | 溶液中一定存在Br-、CO32-,至少存在Na+、NH4+中的一种 |
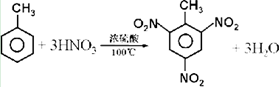 .
.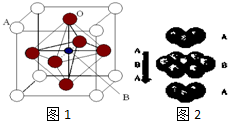 2007年诺贝尔物理学奖为法国科学家阿尔贝•费尔和德国科学家彼得•格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就.某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应.
2007年诺贝尔物理学奖为法国科学家阿尔贝•费尔和德国科学家彼得•格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就.某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应. .
.