题目内容
14.下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确的是( )①KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O;1:6
②3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;2:3
③SiO2+3C═SiC+2CO↑;1:2
④3NO2+H2O═2HNO3+NO;2:1.
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
分析 氧化还原反应中,所含元素化合价降低的物质为氧化剂,所含元素化合价升高的物质为还原剂,根据化学方程式及电子转移数目守恒分析实际参加反应的氧化剂与还原剂物质的量之比.
解答 解:①反应KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O中,氧化剂为KClO3,还原剂为HCl,根据电子转移数目守恒可知,反应中氧化剂与还原剂的物质的量之比为1:5,故①错误;
②反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,氧化剂为HNO3,但8mol硝酸参与反应只有2mol化合价发生降低,所以参加反应的氧化剂为2mol,还原剂为Cu,参加反应的氧化剂与还原剂物质的量之比为2:3,故②正确;
③反应SiO2+3C═SiC+2CO↑中,氧化剂为C,还原剂为C,C元素化合价由0价降低为-4价,由0价升高为+2价,根据电子转移守恒可知,氧化剂与还原剂物质的量之比为1:2,故③正确;
④反应3NO2+H2O═2HNO3+NO,NO2为既是氧化剂,又是还原剂,参加反应的氧化剂与还原剂物质的量之比为1:2,故④错误;
故选:B.
点评 本题考查氧化还原反应计算、基本概念等,理解根据反应中元素的化合价变化断氧化剂、还原剂,掌握根据电子转移守恒计算氧化剂、还原剂物质的量关系.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列各组气体,在常温下能共存的是( )
| A. | NO和O2 | B. | NH3和HCl | C. | NH3和O2 | D. | H2S和SO2 |
5.下列离子方程式书写不正确的是( )
| A. | 往NaOH溶液中通入过量CO2:CO2+OH-═HCO3- | |
| B. | 往水玻璃中加入盐酸:SiO32-+2H+═H2SiO3↓ | |
| C. | 石英砂与烧碱反应制水玻璃:SiO2+2OH-═SiO32-+H2O | |
| D. | 往水玻璃中通入CO2:Na2SiO3+H2O+CO2═H2SiO3+2Na++CO32- |
2.实验室制取氯气可以有以下途径,用化学方程式表示如下.若制取等质量的氯气,消耗盐酸最少的是( )
| A. | 8HCl+K2Cr2O7$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+Cr2O3+3Cl2↑+4H2O | |
| B. | 16HCl+2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$2MnCl2+2KCl+5Cl2↑+8H2O | |
| C. | 4HCl+MnO2═MnCl2+Cl2↑+2H2O | |
| D. | 6HCl+KClO3═KCl+3Cl2↑+3H2O |
6.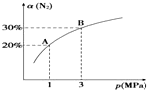 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )| A. | 将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ | |
| B. | 平衡状态由A变到B时,平衡常数K(A)<K(B) | |
| C. | 上述反应在达到平衡后,增大压强,H2的转化率增大 | |
| D. | 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小 |
4.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍.下列说法不正确的( )
| A. | X与Y形成的化合物是离子化合物,且最外层电子均满足8电子结构的 | |
| B. | 工业上通常采用电解Y的熔融氧化物的方法制得Y | |
| C. | 其离子半径大小:Z>Y>X | |
| D. | X和Z的最高价氧化物对应的水化物都是强酸 |
 .
. 2007年诺贝尔物理学奖为法国科学家阿尔贝•费尔和德国科学家彼得•格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就.某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应.
2007年诺贝尔物理学奖为法国科学家阿尔贝•费尔和德国科学家彼得•格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就.某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应. .
.