题目内容
13.有不纯的CuCl2 1.35g,与足量的AgNO3溶液反应,可生成2.9g沉淀,则该氯化铜中所含的杂质可能是下列中的( )| A. | ZnCl2 | B. | KCl | C. | NaCl | D. | BaCl2 |
分析 假设1.35g全部为CuCl2,其物质的量为$\frac{1.35g}{135g/mol}$=0.01mol,与足量盐酸反应,由氯离子守恒可知,生成AgCl为0.01mol×2×143.5g=2.87g<2.9g,说明CuCl2样品中混有的杂质能与硝酸银反应生成AgCl,并且含有的杂质与同质量的CuCl2相比产生AgCl的质量多,即杂质中所含氯元素(氯离子)的质量分数高于CuCl2中氯元素(氯离子)的质量分数.
解答 解:假设1.35g全部为CuCl2,其物质的量为$\frac{1.35g}{135g/mol}$=0.01mol,与足量盐酸反应,由氯离子守恒可知,生成AgCl为0.01mol×2×143.5g=2.87g<2.9g,说明CuCl2样品中混有的杂质能与硝酸银反应生成AgCl,并且含有的杂质与同质量的CuCl2相比产生AgCl的质量多,即杂质中所含氯元素(氯离子)的质量分数高于CuCl2中氯元素(氯离子)的质量分数,
CuCl2中Cu与氯离子离子相对原子质量之比为64:71=32:35.5,
而ZnCl2中Zn与氯离子相对原子质量之比为65:71=32.5:35.5,
KCl中K与氯离子相对原子质量之比为39:35.5,
NaCl中Na与氯离子相对原子质量之比为23:35.5,
BaCl2中Ba与氯离子相对原子质量之比为137:71=68.5:35.5,
故NaCl中氯离子质量分数高于氯化铜的,
故选C.
点评 本题考查混合物计算,关键是利用极限假设法判断杂质满足的条件,灵活运用化学式判断质量分数大小,难度不大.

练习册系列答案
相关题目
3.下列装置或操作不能达到实验目的是( )
| A. |  铁丝的析氢腐蚀实验 | B. | 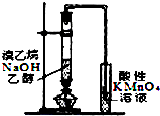 检验该反应的有机产物 | ||
| C. | 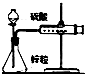 结合秒表测量锌与硫酸的反应速率 | D. | 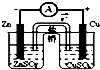 验证化学能转化为电能 |
4.下列各组气体,在常温下能共存的是( )
| A. | NO和O2 | B. | NH3和HCl | C. | NH3和O2 | D. | H2S和SO2 |
8.下列实验操作中,正确的是( )
| A. | 为了使过滤速度加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动 | |
| B. | 燃着的酒精灯打翻失火,应立即用水浇灭 | |
| C. | 为加速固体物质的溶解,可采用粉碎、振荡、搅拌、加热等方法 | |
| D. | 为增大气体物质的溶解度,常采用搅拌、加热等措施 |
5.下列离子方程式书写不正确的是( )
| A. | 往NaOH溶液中通入过量CO2:CO2+OH-═HCO3- | |
| B. | 往水玻璃中加入盐酸:SiO32-+2H+═H2SiO3↓ | |
| C. | 石英砂与烧碱反应制水玻璃:SiO2+2OH-═SiO32-+H2O | |
| D. | 往水玻璃中通入CO2:Na2SiO3+H2O+CO2═H2SiO3+2Na++CO32- |
2.实验室制取氯气可以有以下途径,用化学方程式表示如下.若制取等质量的氯气,消耗盐酸最少的是( )
| A. | 8HCl+K2Cr2O7$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+Cr2O3+3Cl2↑+4H2O | |
| B. | 16HCl+2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$2MnCl2+2KCl+5Cl2↑+8H2O | |
| C. | 4HCl+MnO2═MnCl2+Cl2↑+2H2O | |
| D. | 6HCl+KClO3═KCl+3Cl2↑+3H2O |
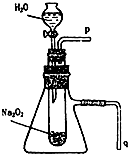 某课外活动小组在做实验时用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.
某课外活动小组在做实验时用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来. 2007年诺贝尔物理学奖为法国科学家阿尔贝•费尔和德国科学家彼得•格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就.某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应.
2007年诺贝尔物理学奖为法国科学家阿尔贝•费尔和德国科学家彼得•格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就.某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应. .
.