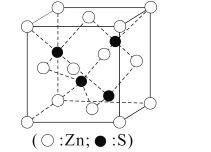
题目内容
【题目】某学习小组探究SO2气体的性质,装置如图所示,下列说法不合理的是( )
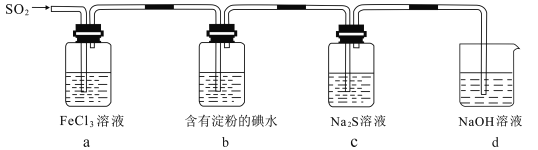
A.a装置中FeCl3溶液逐渐变为浅绿色,说明SO2有还原性
B.c装置Na2S溶液中出现浅黄色浑浊,说明SO2具有氧化性
C.b装置中蓝色退去,说明还原性:SO2> I-
D.b、c装置中发生反应转移的电子数一定相等
【答案】D
【解析】
A.装置中FeCl3溶液逐渐变为浅绿色,SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,说明Fe3+被还原为Fe2+,则SO2被氧化,可以说明SO2具有还原性,A不符合题意;
B.c装置Na2S溶液中出现浅黄色浑浊,说明有单质硫生成,3SO2+2S2-+2H2O=3S↓+2SO32-,二氧化硫具有氧化性,将S2-氧化为硫单质,B不符合题意;
C.装置中蓝色褪去,说明SO2与碘水发生了氧化还原反应,SO2+I2+2H2O=SO42-+2I-+4H+,在该反应中SO2为还原剂, I-为还原产物,根据还原性:还原剂>还原产物,可知还原性:SO2>I-,C不符合题意;
D.甲、乙装置中消耗反应物的物质的量不确定,故反应中转移电子的物质的量不一定相等,D符合题意。
答案选D。

【题目】煤燃烧排放的烟气含有SO2和NO,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)NaClO2中Cl元素的价态为_______。
(2)在鼓泡反应器中通入含有含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1 。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①在NaClO2溶液脱硝的主要反应中,参加反应的n(ClO2-):n(NO)=_________,增加压强,NO的转化率______(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐_______(填“升高”“不变”或“降低”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pc如下图所示:
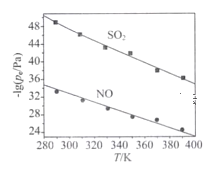 =
=
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均____(填“增大”“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。