题目内容
15. 如图(Ⅰ)表示反应:mA(g)+nB(g)?pC(g)+qD(g);△H.在不同温度下经过一定时间混合气体体系中C的百分含量与温度T的关系.图(Ⅱ)表示在一定条件下达到平衡后,t时刻改变压强,重新建立平衡的反应过程.由此可判断该反应中( )
如图(Ⅰ)表示反应:mA(g)+nB(g)?pC(g)+qD(g);△H.在不同温度下经过一定时间混合气体体系中C的百分含量与温度T的关系.图(Ⅱ)表示在一定条件下达到平衡后,t时刻改变压强,重新建立平衡的反应过程.由此可判断该反应中( )| A. | m+n>p+q,△H<0 | B. | m+n>p+q,△H>0 | C. | m+n<p+q,△H>0 | D. | m+n<p+q,△H<0 |
分析 根据图1可知,在最高点之前是建立平衡的曲线,在最高点之后是平衡受温度影响的曲线,可以看出,温度越高C的质量分数越小,说明平衡逆向移动,说明该反应的正反应是放热反应,在图2中,t时刻(温度不变)正逆反应速率都同时突然增大,所以改变影响平衡的条件应该是增大压强,而此时逆反应速率大于正反应速率,说明平衡逆向移动,由此可确定该反应的正反应是气体体积增大的反应,据此答题.
解答 解:根据图1可知,在最高点之前是建立平衡的曲线,在最高点之后是平衡受温度影响的曲线,可以看出,温度越高C的质量分数越小,说明平衡逆向移动,说明该反应的正反应是放热反应,即△H<0,在图2中,t时刻(温度不变)正逆反应速率都同时突然增大,所以改变影响平衡的条件应该是增大压强,而此时逆反应速率大于正反应速率,说明平衡逆向移动,由此可确定该反应的正反应是气体体积增大的反应,即m+n<p+q,
故选D.
点评 本题主要考查了影响平衡移动的因素,中等难度,解题的关键在于正确理解图象的意义.

练习册系列答案
相关题目
6.下列装置所示的实验中,能达到实验目的是( )
| A. |  从Mg(OH)2悬浊液中分离出Mg(OH)2 | B. |  除去Cl2中的HCl | ||
| C. | 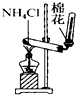 实验室制氨气 | D. | 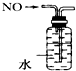 排水法收集NO |
3.下列物质按照单质、化合物、混合物顺序排列,其中物质类型排列顺序正确的是( )
| A. | 氯水、氯化钾、胆矾 | |
| B. | 液溴、水和冰混合、澄清石灰水 | |
| C. | 氮气、净化后的空气、氧化镁 | |
| D. | 白鳞、生锈的铁钉、高锰酸钾充分加热后的剩余固体 |
20.在Al(NO3)3和NaHSO4的混合溶液,能够大量共存的粒子组是( )
| A. | Ba2+、OH-、Mg2+、Cl- | B. | Fe2+、SO32-、Cu2+、AlO2- | ||
| C. | HCO3-、I-、Cl-、Cu2+ | D. | Fe3+、Cu2+、Cl-、H+、 |
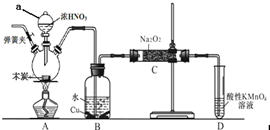 亚硝酸钠在漂白、电镀等方面应用广泛.现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略).
亚硝酸钠在漂白、电镀等方面应用广泛.现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略).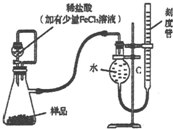 过氧化镁MgO2易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常混有少量MgO,实验室可通过多种方案测定样品过氧化镁的含量.
过氧化镁MgO2易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常混有少量MgO,实验室可通过多种方案测定样品过氧化镁的含量. .
.