题目内容
4.实验室常用硫酸来制取气体,试填出硫酸在这些反应中表现出的性质:(1)用浓硫酸和NaCl反应制取HCl难挥发性;
(2)用稀硫酸和Zn反应制取H2酸性,酸的氧化性;
(3)用Cu与浓硫酸加热反应制取二氧化硫酸性、强氧化性.
分析 依据浓硫酸沸点高,难挥发,具有强的氧化性、酸性解答,反应中硫元素化合价降低,则浓硫酸表现强的氧化性,硫元素化合价不变,则表现为酸性,据此解答.
解答 解:(1)浓硫酸具有难挥发性,氯化氢易挥发,所以用浓硫酸和NaCl反应制取HCl,2NaCl+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl,体现浓硫酸难挥发性,
故答案为:难挥发性;
(2)稀硫酸与锌反应方程式:Zn+H2SO4═ZnSO4+H2↑,硫元素化合价不变,氢离子化合价降低,表现为酸的氧化性,体现硫酸的酸性,
故答案为:酸性,酸的氧化性;
(2)铜与浓硫酸在加热条件下反应,CuO+H2SO4=CuSO4+H2O,反应中部分硫元素化合价降低,部分化合价不变,既表现浓硫酸强的氧化性,又表现酸性;
故答案为:强氧化性;酸性.
点评 本题考查了元素化合物知识,侧重考查浓硫酸的性质,明确硫酸的性质及在反应中硫元素化合价变化是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列化学用语正确的是( )
| A. | N2的电子式: | B. | K+的结构示意图: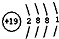 | ||
| C. | H2O2的电子式: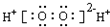 | D. | CO2的结构式O=C=O |
15. 如图(Ⅰ)表示反应:mA(g)+nB(g)?pC(g)+qD(g);△H.在不同温度下经过一定时间混合气体体系中C的百分含量与温度T的关系.图(Ⅱ)表示在一定条件下达到平衡后,t时刻改变压强,重新建立平衡的反应过程.由此可判断该反应中( )
如图(Ⅰ)表示反应:mA(g)+nB(g)?pC(g)+qD(g);△H.在不同温度下经过一定时间混合气体体系中C的百分含量与温度T的关系.图(Ⅱ)表示在一定条件下达到平衡后,t时刻改变压强,重新建立平衡的反应过程.由此可判断该反应中( )
 如图(Ⅰ)表示反应:mA(g)+nB(g)?pC(g)+qD(g);△H.在不同温度下经过一定时间混合气体体系中C的百分含量与温度T的关系.图(Ⅱ)表示在一定条件下达到平衡后,t时刻改变压强,重新建立平衡的反应过程.由此可判断该反应中( )
如图(Ⅰ)表示反应:mA(g)+nB(g)?pC(g)+qD(g);△H.在不同温度下经过一定时间混合气体体系中C的百分含量与温度T的关系.图(Ⅱ)表示在一定条件下达到平衡后,t时刻改变压强,重新建立平衡的反应过程.由此可判断该反应中( )| A. | m+n>p+q,△H<0 | B. | m+n>p+q,△H>0 | C. | m+n<p+q,△H>0 | D. | m+n<p+q,△H<0 |
12.下列各组仪器中,能用酒精灯直接加热的一组是( )
| A. | 燃烧匙、集气瓶 | B. | 蒸发皿、试管 | C. | 坩埚、烧杯 | D. | 烧瓶、烧杯 |
19.下列各组气体在常温、常压下能共存且能用浓硫酸干燥的是( )
| A. | SO2、O2、H2S | B. | H2、O2、F2 | C. | O2、C12、HBr | D. | H2S、CO2、H2 |
9.下列说法不正确的是( )
| A. | 化学反应过程中吸收或释放的热量称为反应热 | |
| B. | 已知:2H2(g)+O2(g)═2H2O(l)△H1=-571.6 kJ•mol-1,是指每摩尔氢气完全燃烧放出的热量571.6 kJ | |
| C. | 醋酸与氢氧化钠溶液的中和反应是放热反应 | |
| D. | 热化学方程式中各物质前面的化学计量数可以是分数 |
14. 往一体积不变的密闭容器中充入A2和B2,发生反应A2(g)+B2(g)?2C(g)△H>0;当达到平衡后,t0时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大.下列说法正确的是( )
往一体积不变的密闭容器中充入A2和B2,发生反应A2(g)+B2(g)?2C(g)△H>0;当达到平衡后,t0时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大.下列说法正确的是( )
 往一体积不变的密闭容器中充入A2和B2,发生反应A2(g)+B2(g)?2C(g)△H>0;当达到平衡后,t0时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大.下列说法正确的是( )
往一体积不变的密闭容器中充入A2和B2,发生反应A2(g)+B2(g)?2C(g)△H>0;当达到平衡后,t0时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大.下列说法正确的是( )| A. | 平衡向逆反应方向移动,平均相对分子质量不变 | |
| B. | 平衡向正反应方向移动,混合气体密度增大 | |
| C. | A2转化率增大,C平衡浓度变大 | |
| D. | t0时降低体系温度 |
