题目内容
8.下列各表述与示意图一致的是( )| A. |  表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. |  图中曲线表示反应2SO2 (g)+O2 (g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 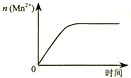 表示10 mL 0.01 mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1H2 C2 O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 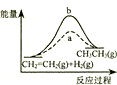 图中a、b曲线分别表示反应CH2=CH2 (g)+H2 (g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
分析 A、盐酸滴定氢氧化钠,PH先下降后突变;
B、因反应为放热反应,则升高温度,平衡逆向移动,平衡后升温K逆减小,而K正增大,且正逆反应的平衡常数互为倒数关系;
C、10 mL 0.01 mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1H2 C2 O4溶液混合时发生氧化还原反应生成草酸钾,草酸锰、二氧化碳和水,
D、因该反应是放热反应,应反应物的总能量大于生成物的总能量;
解答 解:A、0.1mol•L-1NaOH溶液的pH为13,用0.1mol•L-1盐酸滴定恰好中和时pH为7,因浓度相同,则体积相同,但酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,故A错误;
B、因反应为放热反应,则升高温度,平衡逆向移动,平衡后升温K逆减小,而K正增大,且正逆反应的平衡常数互为倒数关系,故B正确;
C、该反应是放热反应,反应生成的Mn2+对该反应有催化作用,故反应速率越来越快,不是恒定速率,故C错误;
D、图象a活化能减小,a使用了催化剂,因该反应是放热反应,应反应物的总能量大于生成物的总能量,但图象描述是吸热反应,故D错误;
故选B.
点评 本题以图象与中和滴定、化学平衡、氧化还原反应、反应中的能量变化来考查学生,这些知识点是新课程改革考查的重点,明确考点“形变神不变”,做到善于抓规律、编网络来掌握即可,题目难度中等.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
19.从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下:

则下列说法正确的是( )

则下列说法正确的是( )
| A. | 试剂a是铁、试剂b是稀硫酸 | |
| B. | 操作I、操作Ⅱ、操作Ⅲ所用仪器相同 | |
| C. | 试剂c是氯气,相应的反应为:2Fe2++Cl2═2Cl-+2Fe3+ | |
| D. | 用酸性KMnO4溶液可检验溶液W中是否还有Fe2+ |
16.下列表示电子式的形成过程正确的是( )
| A. | H+ → →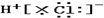 | B. | Na×+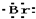 →Na →Na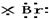 | ||
| C. | Mg${\;}_{×}^{×}$+2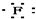 →Mg2+ →Mg2+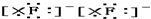 | D. |  +${\;}_{×}^{×}$C${\;}_{×}^{×}$ +${\;}_{×}^{×}$C${\;}_{×}^{×}$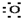 → →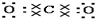 |
3.下列操作达不到预期目的是( )
①石油分馏时把温度计插入受热的液体中
②用酸性高锰酸钾溶液除去乙炔中含有的H2S
③用溴乙烷与氢氧化钠溶液加热制取乙烯
④将苯和溴水混合后加入铁粉制取溴苯
⑤将敞口久置的电石与蒸馏水混合制乙炔.
①石油分馏时把温度计插入受热的液体中
②用酸性高锰酸钾溶液除去乙炔中含有的H2S
③用溴乙烷与氢氧化钠溶液加热制取乙烯
④将苯和溴水混合后加入铁粉制取溴苯
⑤将敞口久置的电石与蒸馏水混合制乙炔.
| A. | 只有①⑤ | B. | 只有③④⑤ | C. | 只有①②③⑤ | D. | ①②③④⑤ |
13.X、Y、Z三种元素的原子,其核外电子排布分别为:X原子最外层有一个电子,Y原子的第一、二、三层电子数分别为2、8、3,Z原子第一、二层电子数为2、6,由这三种元素组成的化合物的化学式可能是( )
| A. | XYZ2 | B. | XYZ3 | C. | X2YZ2 | D. | X2YZ3 |
20.下列物质的溶液中所含离子种类最多的是( )
| A. | Na2S | B. | Na3PO4 | C. | Na2CO3 | D. | AlCl3 |
18.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,2.24 L Cl2通入足量NaOH溶液中,反应转移电子的数目为0.2NA | |
| B. | 1 mol K与足量O2反应,生成K2O、K2O2和KO2的混合物时转移的电子数为NA | |
| C. | 常温常压下,1.7 g H2O2中含有的电子数为NA | |
| D. | 标准状况下,1 mol CO2所含共用电子对数为2NA |