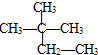
题目内容
18.NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 标准状况下,2.24 L Cl2通入足量NaOH溶液中,反应转移电子的数目为0.2NA | |
| B. | 1 mol K与足量O2反应,生成K2O、K2O2和KO2的混合物时转移的电子数为NA | |
| C. | 常温常压下,1.7 g H2O2中含有的电子数为NA | |
| D. | 标准状况下,1 mol CO2所含共用电子对数为2NA |
分析 A、氯气与氢氧化钠的反应为歧化反应;
B、根据反应后钾元素为+1价来分析;
C、求出双氧水的物质的量,然后根据1mol双氧水中含18mol电子来计算;
D、1mol二氧化碳中含4mol共用电子对.
解答 解;A、标况下,2.24L氯气的物质的量为0.1mol,而氯气与氢氧化钠的反应为歧化反应,0.1mol氯气转移0.1mol电子即0.1NA个,故A错误;
B、由于反应后钾元素为+1价,故1molK反应转移1mol电子,与生成的产物无关,故B正确;
C、1.7g双氧水的物质的量n=$\frac{1.7g}{34g/mol}$=0.05mol,而1mol双氧水中含18mol电子,故0.05mol双氧水中含0.9mol电子即0.9NA个,故C错误;
D、二氧化碳中含2条碳氧双键,故1mol二氧化碳中含4mol共用电子对即4NA对,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
8.下列各表述与示意图一致的是( )
| A. |  表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. |  图中曲线表示反应2SO2 (g)+O2 (g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 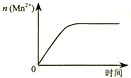 表示10 mL 0.01 mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1H2 C2 O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 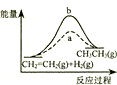 图中a、b曲线分别表示反应CH2=CH2 (g)+H2 (g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
9.某K2CO3样品可能含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将13.8g样品加入足量水,样品全部溶解,再加入过量CaCl2溶液,得到9g沉淀.以下对样品所含杂质的判断正确的是( )
| A. | 肯定有KNO3 | B. | 肯定没有Ba(NO3)2,可能含有KNO3 | ||
| C. | 肯定没有Ba(NO3)2和Na2CO3 | D. | 肯定有KNO3,可能还含有Na2CO3 |
6.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 石油、沼气、天然气、植物油都属于可再生能源 | |
| B. | 水蒸气变为液态水时放出的能量就是该变化的反应热 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
13.一定温度下,下列溶液的离子浓度关系式正确的是( )
| A. | pH=5的H2S溶液中:c(OH-)+c(HS-)=1×10-5mol•L-1 | |
| B. | pH相同的①NH4F ②NH4Cl ③NH4Al(SO4)2三种溶液的物质的量浓度 ①>②>③ | |
| C. | pH=2 的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) | |
| D. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 |
3.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 0.1 mol.L-1NaCl溶液中Na+的数目为0.1NA | |
| B. | 标准状况下,11.2 L H2O中含有分子的数目为0.5NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 1 mol Na被完全氧化生成Na2O2,失去个电子数为2NA |
10.下列现象中,一定发生化学变化的是( )
| A. | 瓷碗破碎 | B. | 铁丝弯曲 | C. | 蜡烛燃烧 | D. | 冰雪融化 |
8.霉酚酸(Mycophenolic acid)是一种生物活性化合物.下列有关霉酚酸的说法正确的是( )


| A. | 一定条件下,1mol霉酚酸最多可与3molH2反应 | |
| B. | 处于同一平面的碳原子至多9个 | |
| C. | 只有2个官能团 | |
| D. | 分子式为:C17H20O6 |
 和
和 ⑧
⑧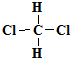 和
和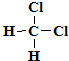 ⑨
⑨ 和
和