题目内容
3.已知反应M+N=X+Y为吸热反应,对这个反应的下列说法正确的是( )| A. | M的能量一定低于X的,N的能量一定低于Y的 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中化学键吸收的能量小于形成生成物中化学键所放出的能量 | |
| D. | M和N的总能量一定低于X和Y的总能量 |
分析 反应X+Y=M+N为吸热反应,则X、Y的总能量小于M、N的总能量,吸热反应的反应条件不一定需要加热,且该反应中断裂化学键吸收的热量大于生成键释放的能量.
解答 解:A.由吸热反应,则X、Y的总能量小于M、N的总能量,但无法确定X与M、Y与N的能量高低,故A错误;
B.该反应为吸热反应,与反应条件无关,该反应可能需要加热,也可能不需要加热,故B错误;
C.该反应为吸热反应,则断裂化学键吸收的热量大于生成键释放的能量,故C错误;
D.反应X+Y=M+N为吸热反应,则X、Y的总能量小于M、N的总能量,故D正确;
故选D.
点评 本题考查吸热反应,明确化学反应中能量变化的实质及利用反应物、生成物的总能量的相对大小判断吸热反应、放热反应的方法即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列物质的熔、沸点高低顺序不正确的是( )
| A. | F2<Cl2<Br2<I2 | B. | CF4>CCl4>CBr4>CI4 | ||
| C. | HCl<HBr<HI<HF | D. | CH4<SiH4<GeH4<SnH4 |
14.反应N2(g)+3H2(g)?2NH3(g),下列表示化学反应速率最快的是( )
| A. | v(N2)=0.40 mol•L-1•s-1 | B. | v(NH3)=1.20 mol•L-1•min-1 | ||
| C. | v(NH3)=0.60 mol•L-1•s-1 | D. | v(H2)=0.80 mol•L-1•s-1 |
18.100℃时,KW=1×10-12,对纯水的叙述正确的是( )
| A. | KW是常温时的10-2倍 | B. | 温度不变冲稀10倍,pH=7 | ||
| C. | pH=6显弱酸性 | D. | c(H+)=10-6mol/L,溶液为中性 |
8.用括号中的试剂除去各组中的杂质,正确的是( )
| A. | 苯中的甲苯(溴水) | B. | 95.6%乙醇中的水(CaO) | ||
| C. | 乙烷中的乙烯(酸性高锰酸钾) | D. | 溴苯中的溴(苯) |
15.Cu2O是一种红色或黄色的粉末,在工业上可用作有机合成催化剂或电子工业材料等.
(1)工业上可以用Na2SO3 还原CuSO4 的方法制备Cu2O,反应控制的温度为100℃~105℃,pH为3.5~5.5,其反应的化学方程式为2CuSO4+3Na2SO3═Cu2O+3Na2SO4+2SO2↑.也可以用电解法制备,电解时以铜作阳极,氢氧化钠为电解质溶液,写出电解时阳极发生的电极反应:2Cu-2e-+2OH-=Cu2O↓+H2O.
(2)某同学在实验室发现了一瓶使用过的红色粉末,且实验室中只有Fe2O3 和Cu2O两种颜色为红色的试剂,因此他就通过实验来探究该红色粉末的成分,已知Cu2O是一种碱性氧化物,溶于稀H2SO4生成Cu和CuSO4 ,在空气中加热生成CuO.
①请完成Cu2O与稀H2SO4反应的化学方程式:
Cu2O+H2SO4═Cu+CuSO4 +H2O;
②提出合理的假设:
假设1:红色粉末是Fe2O3 ;
假设2:红色粉末是Cu2O;
假设3:红色粉末是Fe2O3 和Cu2O的混合物.
③设计探究实验:
共选择的试剂:3mol•L-1 稀H2SO4、1mol•L-1 NaOH溶液、20%的KSCN溶液,3%的H2O2 溶液,稀HNO3、光亮的铁丝.
(1)工业上可以用Na2SO3 还原CuSO4 的方法制备Cu2O,反应控制的温度为100℃~105℃,pH为3.5~5.5,其反应的化学方程式为2CuSO4+3Na2SO3═Cu2O+3Na2SO4+2SO2↑.也可以用电解法制备,电解时以铜作阳极,氢氧化钠为电解质溶液,写出电解时阳极发生的电极反应:2Cu-2e-+2OH-=Cu2O↓+H2O.
(2)某同学在实验室发现了一瓶使用过的红色粉末,且实验室中只有Fe2O3 和Cu2O两种颜色为红色的试剂,因此他就通过实验来探究该红色粉末的成分,已知Cu2O是一种碱性氧化物,溶于稀H2SO4生成Cu和CuSO4 ,在空气中加热生成CuO.
①请完成Cu2O与稀H2SO4反应的化学方程式:
Cu2O+H2SO4═Cu+CuSO4 +H2O;
②提出合理的假设:
假设1:红色粉末是Fe2O3 ;
假设2:红色粉末是Cu2O;
假设3:红色粉末是Fe2O3 和Cu2O的混合物.
③设计探究实验:
共选择的试剂:3mol•L-1 稀H2SO4、1mol•L-1 NaOH溶液、20%的KSCN溶液,3%的H2O2 溶液,稀HNO3、光亮的铁丝.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量红色粉末于试管中,并加入过量3mol•L-1 稀H2SO4,充分反应后,将上层清液分成两份 | (1)若有红色固体剩余,则假设2,3可能成立; (2)若无红色固体剩余,则假设1,3可能成立 |
| 若步骤1中有红色固体剩余; 步骤2:取步骤1充分反应后的上层清液于试管中,加入足量3%的H2O2 溶液,再加入几滴20%的KSCN溶液 | 若溶液仍为蓝色,则假设2成立; |
| 若步骤1中有红色固体剩余; 步骤3:取步骤1充分反应后的上层清液于试管中,加入足量3%的H2O2 溶液,再加入几滴20%的KSCN溶液 | 若溶液变为血红色,则假设3成立. |
17.下列物质中,只含极性共价键的化合物是( )
| A. | H2O | B. | Cl2 | C. | NH4Cl | D. | NaOH |
 ;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
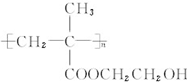 .
.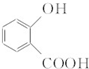 和CH3COOH(写结构简式).
和CH3COOH(写结构简式).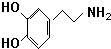 )是人体大脑中的一种有机物质叫做多巴胺.
)是人体大脑中的一种有机物质叫做多巴胺.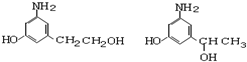 .
. 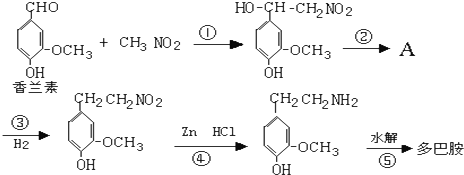
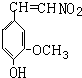 .
.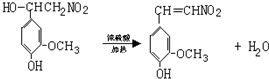 ,⑤:
,⑤: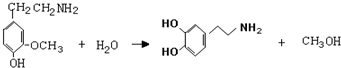 .
.