题目内容
6.设N0为阿伏加德罗常数的值,下列说法中正确的是( )| A. | 18gH2O所含的电子数目为9N0 | |
| B. | 0.1 mol/L Na2SO4溶液所含Na+数目为0.2N0 | |
| C. | 1 mol钠完全反应时所失去的电子数为N0 | |
| D. | 标准状况下22.4L O2所含的原子数目为N0 |
分析 A.根据n=$\frac{m}{M}$结合分子构成计算,1个水分子含有10个电子;
B.根据n=cV分析,缺少体积无法计算钠离子的物质的量;
C.根据电子守恒计算出1 mol钠完全反应失去的电子数;
D.根据n=$\frac{V}{{V}_{m}}$计算,1个氧气分子含有2个原子;
解答 解:A.n(H2O)=$\frac{18g}{18g/mol}$=1mol,含有的电子的物质的量为1mol×10=10mol=10N0,故A错误;
B.根据n=cV分析,0.1 mol/L Na2SO4溶液,体积未知,无法计算钠离子的物质的量,故B错误;
C.钠原子最外层有1个电子,1mol钠,完全反应失去1mol电子,失去的电子数为N0,故C正确;
D.标准状况下22.4L O2n=$\frac{V}{{V}_{m}}$=$\frac{22.4L}{22.4L/mol}$=1mol,1个氧气分子含有2个原子,所含的原子数目为2N0,故D错误;
故选C.
点评 本题考查物质的量的相关计算,侧重于学生的分析和计算能力的考查,为高频考点,注意把握相关计算公式与相关物理量的关系,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.下列物质中,只含极性共价键的化合物是( )
| A. | H2O | B. | Cl2 | C. | NH4Cl | D. | NaOH |
14.在高温、高压和有催化剂的恒容密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g).下列叙述正确的是( )
| A. | 降低温度可以加快反应速率 | |
| B. | 使用合适的催化剂可以加快反应的速率 | |
| C. | 在上述条件下,氢气能全部转化为氨气 | |
| D. | 达到平衡时,体系中各物质的浓度一定相等 |
1.下列关于氨的叙述正确的是( )
| A. | 可用向上排空气法收集氨气 | |
| B. | 氨气极易溶于水,因此加热浓氨水不会产生氨气 | |
| C. | 将两根分别蘸有浓氨水和浓硫酸的玻璃棒靠近时,有白烟产生 | |
| D. | 在实验室中,可用加热氢氧化钙和氯化铵的固体混合物的方法制取氨气 |
15.某强酸性溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下

下列有关推断合理的是( )

下列有关推断合理的是( )
| A. | 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05 mol•L-1 | |
| B. | 沉淀H为Al(OH)3、BaCO3的混合物 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 根据上述连续实验不能确定溶液X中是否含有Fe3+ |
16.碘是人体必需的微量元素,127I的中子数为74,则其原子序数为( )
| A. | 74 | B. | 53 | C. | 201 | D. | 127 |
 ;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
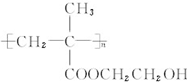 .
.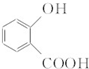 和CH3COOH(写结构简式).
和CH3COOH(写结构简式).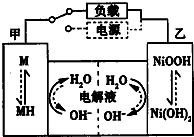 近期因“召回门”而闹得沸沸扬扬的丰田Prius属于第三代混合动力车,可以用电动机、内燃机或二者结合驱动车轮.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态.
近期因“召回门”而闹得沸沸扬扬的丰田Prius属于第三代混合动力车,可以用电动机、内燃机或二者结合驱动车轮.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态.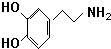 )是人体大脑中的一种有机物质叫做多巴胺.
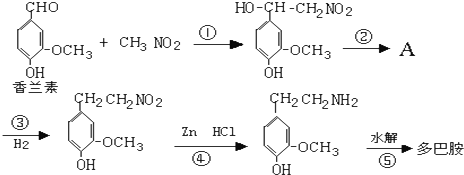
)是人体大脑中的一种有机物质叫做多巴胺.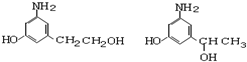 .
. 
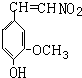 .
.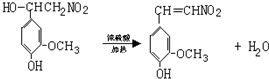 ,⑤:
,⑤: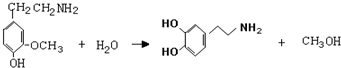 .
.