题目内容
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.尿素(H2NCONH2)可用于制有机铁肥,主要代表有 [Fe(H2NCONH2)6](NO3)3 [三硝酸六尿素合铁(Ⅲ)]。
⑴基态Fe3+的核外电子排布式为 。C、N、O三种元素的第一电离能由大到小的顺序是 。
⑵尿素分子中C、N原子的杂化方式分别是 。
⑶[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是 。与NO3—互为等电子体的一种化合物是 (写化学式)。
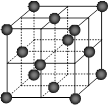
⑷CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如右图所示。
1个CO2分子周围等距离且距离最近的CO2分子有 个。
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是 。
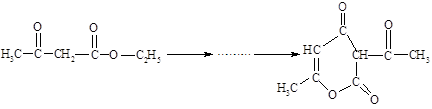
B.脱氢醋酸是一种难溶于水的低毒、高效广谱抗菌剂,可由乙酰乙酸乙酯经脱醇缩合而成,反应原理为:
实验步骤如下:
①在反应器中加入乙酰乙酸乙酯、少量催化剂和数粒沸石,在瓶口安装分馏装置。
②低温加热(不超过85℃)60~70min;然后大火加热蒸出乙醇。
③将反应液趁热倒入烧杯中,冷却到室温,有柠檬黄色晶体析出。
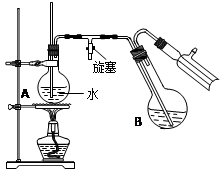
④将柠檬黄色晶体转移至圆底烧瓶B中,加水15mL,滴入1滴硫酸,进行水蒸气蒸馏(如图所示)。从水蒸气蒸馏液中经抽滤可分离出脱氢醋酸,再烘干即得成品。
步骤①中加入沸石的目的是 。
步骤②中,在60~70min内低温加热的目的是 ,然后大火加热蒸出乙醇的目的是 。
步骤④中水蒸气蒸馏装置中烧瓶A的作用是 ,玻璃管的作用是 。
用测得相对分子质量的方法,可以检验所得产物是否纯净,测得相对分子质量通常采用的仪器是 。
A.尿素(H2NCONH2)可用于制有机铁肥,主要代表有 [Fe(H2NCONH2)6](NO3)3 [三硝酸六尿素合铁(Ⅲ)]。
⑴基态Fe3+的核外电子排布式为 。C、N、O三种元素的第一电离能由大到小的顺序是 。
⑵尿素分子中C、N原子的杂化方式分别是 。
⑶[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是 。与NO3—互为等电子体的一种化合物是 (写化学式)。
⑷CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如右图所示。
1个CO2分子周围等距离且距离最近的CO2分子有 个。
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是 。

B.脱氢醋酸是一种难溶于水的低毒、高效广谱抗菌剂,可由乙酰乙酸乙酯经脱醇缩合而成,反应原理为:

实验步骤如下:
①在反应器中加入乙酰乙酸乙酯、少量催化剂和数粒沸石,在瓶口安装分馏装置。
②低温加热(不超过85℃)60~70min;然后大火加热蒸出乙醇。
③将反应液趁热倒入烧杯中,冷却到室温,有柠檬黄色晶体析出。
④将柠檬黄色晶体转移至圆底烧瓶B中,加水15mL,滴入1滴硫酸,进行水蒸气蒸馏(如图所示)。从水蒸气蒸馏液中经抽滤可分离出脱氢醋酸,再烘干即得成品。

步骤①中加入沸石的目的是 。
步骤②中,在60~70min内低温加热的目的是 ,然后大火加热蒸出乙醇的目的是 。
步骤④中水蒸气蒸馏装置中烧瓶A的作用是 ,玻璃管的作用是 。
用测得相对分子质量的方法,可以检验所得产物是否纯净,测得相对分子质量通常采用的仪器是 。
A⑴[Ar]3d5 N>O>C
⑵sp2、sp3
⑶配位键 SO3(或BF3)
⑷①12 ②1∶3(除第⑷小题每空1分外,其余每空2分,共12分)
B ⑴防止暴沸
⑵使原料充分反应而不被蒸馏出去使平衡正向移动,提高原料的利用率
⑶提供水蒸气起稳压作用(既能防止装置中压强过大引起事故、又能防止压强过小引起倒吸)
⑷质谱仪
(每空2分,共12分)
⑵sp2、sp3
⑶配位键 SO3(或BF3)
⑷①12 ②1∶3(除第⑷小题每空1分外,其余每空2分,共12分)
B ⑴防止暴沸
⑵使原料充分反应而不被蒸馏出去使平衡正向移动,提高原料的利用率
⑶提供水蒸气起稳压作用(既能防止装置中压强过大引起事故、又能防止压强过小引起倒吸)
⑷质谱仪
(每空2分,共12分)
A⑴基态铁原子失去最外层两个电子及次外层一个电子可得到Fe3+,Fe3+的核外电子排布式为:[Ar]3d5
同周期自左至右第一电离能增大,但由于N原子电子为半充满状态,故N的第一电离能相对大于O元素,故顺序为N>O>C
(2)尿素分子中C形成了羰基,杂化方式为sp2,N原子除形成三个共价键外,还存在一孤对电子,杂化方式为sp3
(3)[Fe(H2NCONH2)6](NO3)3为络合物,其中中“H2NCONH2”与Fe(Ⅲ)之间的作用力是配位键;
等电子体是指价电子总数及原子总数相同,与NO3—互为的等电子体的例如:SO3、BF3等
⑷①在X、Y、Z三平面上分别有4个分子,故12个分子符合题意
②Au与Cu原子数之比为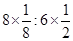 =1:3
=1:3
B ⑴沸石具有缓解液体沸腾的作用,防止液体暴沸
(2)有机反应物的沸点较低,为防止其挥发,一般需要低温加热;而大火加热蒸出乙醇可减少产物浓度,使平衡正向移动,提高原料的利用率
(3)既能防止装置中压强过大引起事故、又能防止压强过小引起倒吸
(4)质谱仪经常用以测定有机物的相对分子质量
同周期自左至右第一电离能增大,但由于N原子电子为半充满状态,故N的第一电离能相对大于O元素,故顺序为N>O>C
(2)尿素分子中C形成了羰基,杂化方式为sp2,N原子除形成三个共价键外,还存在一孤对电子,杂化方式为sp3
(3)[Fe(H2NCONH2)6](NO3)3为络合物,其中中“H2NCONH2”与Fe(Ⅲ)之间的作用力是配位键;
等电子体是指价电子总数及原子总数相同,与NO3—互为的等电子体的例如:SO3、BF3等
⑷①在X、Y、Z三平面上分别有4个分子,故12个分子符合题意
②Au与Cu原子数之比为
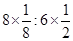 =1:3
=1:3B ⑴沸石具有缓解液体沸腾的作用,防止液体暴沸
(2)有机反应物的沸点较低,为防止其挥发,一般需要低温加热;而大火加热蒸出乙醇可减少产物浓度,使平衡正向移动,提高原料的利用率
(3)既能防止装置中压强过大引起事故、又能防止压强过小引起倒吸
(4)质谱仪经常用以测定有机物的相对分子质量

练习册系列答案
相关题目

