题目内容
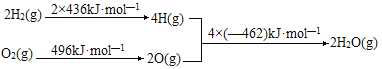
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g) △H>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g)+O2(g) △H>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L—1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A. 500s内O2的平均生成速率为7.4×l0—4mol·L—1·s—1
B. T1温度下该反应达到平衡时,平衡混合物中NO2的体积分数为50%
C. 达到平衡后,其他条件不变,将容器体积压缩到原来的1/2,则c(N2O5)>5.00mol·L—1
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1<K2,则T1>T2
【答案】C
【解析】试题分析:500s内c(N2O5)的变化量为1.48 mol·L—1,O2的变化量为0.74mol·L—1,O2平均生成速率为![]() =1.48×l0—3mol·L—1·s—1,故A错误;
=1.48×l0—3mol·L—1·s—1,故A错误;
平衡混合物中NO2的体积分数为![]() 57%,故B错误;达到平衡后,其他条件不变,将容器体积压缩到原来的1/2平衡逆向移动,则c(N2O5)>5.00mol·L—1,故C正确;△H>0,升高温度平衡正向移动,K增大,故D错误。
57%,故B错误;达到平衡后,其他条件不变,将容器体积压缩到原来的1/2平衡逆向移动,则c(N2O5)>5.00mol·L—1,故C正确;△H>0,升高温度平衡正向移动,K增大,故D错误。

 阅读快车系列答案
阅读快车系列答案【题目】Ⅰ.已知:Na2S2O3+H2SO4==Na2SO4+SO2↑+S↓+H2O。某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号 | 反应温度 | Na2S2O3浓度[ | 稀硫酸 | H2O | ||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(1)该实验①、②可探究 对反应速率的影响,因此V1、V2和V3分别是 、 、 。
(2)实验①、③可探究 对反应速率的影响,因此V4、V5分别是 、 。
Ⅱ.二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L)。如图中的曲线表示二氧化氮分解反应在前25秒内的反应进程。
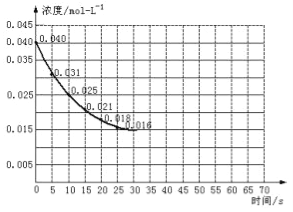
(3)前20秒内氧气的平均生成速率 mol/(L·s)
(4)在某温度下达到平衡时的平衡常数表达式是 。
(5)在某温度下达到平衡后,不改变其它条件,向该容器中再加入少量的NO2,平衡移动的方向是 ,NO2的平衡转化率 68.75%(填“>”、“<”或“=”),NO的体积百分含量 (填“增大”、“减小”或“不变”)。
(6)若在反应开始时加入催化剂(其他条件都不变),反应经过20秒达到平衡,请在图上用虚线画出加催化剂后反应0~70s的曲线。