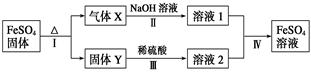
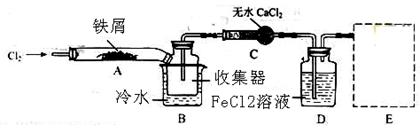
题目内容
足量的一氧化碳还原14.5 g铁的氧化物的混合物。将生成的气体通入足量的澄清石灰水中,生成沉淀25 g,则该混合物的组合不可能是
①Fe2O3、Fe3O4、FeO;②FeO、Fe3O4;③Fe3O4、Fe2O3;④FeO、Fe2O3
①Fe2O3、Fe3O4、FeO;②FeO、Fe3O4;③Fe3O4、Fe2O3;④FeO、Fe2O3
| A.①② | B.②③ | C.③④ | D.①④ |
B
试题分析:CO还原铁的氧化物生成CO2,CO2与氢氧化钙反应生成碳酸钙,即25g是碳酸钙的质量,物质的量=25g÷100g/mol÷0.25mol。则根据原子守恒可知CO
 CO2→CaCO3,金属氧化物中氧元素的物质的量是0.25mol,其质量=0.25mol×16g/mol=4g。则金属氧化物中铁元素的质量=14.5g-4g=10.5g,物质的量=105.g÷56g/mol=0.1875mol,所以金属氧化物中铁与氧元素的个数之比=0.1875:0.25=3:4。由于氧化铁与氧化亚铁按照物质的量之比1:1混合即可以满足铁与氧元素的个数之比=3:4,所以选项①、④均有可能,而选项②③不可能满足铁与氧元素的个数之比=3:4,因此正确的答案选B。
CO2→CaCO3,金属氧化物中氧元素的物质的量是0.25mol,其质量=0.25mol×16g/mol=4g。则金属氧化物中铁元素的质量=14.5g-4g=10.5g,物质的量=105.g÷56g/mol=0.1875mol,所以金属氧化物中铁与氧元素的个数之比=0.1875:0.25=3:4。由于氧化铁与氧化亚铁按照物质的量之比1:1混合即可以满足铁与氧元素的个数之比=3:4,所以选项①、④均有可能,而选项②③不可能满足铁与氧元素的个数之比=3:4,因此正确的答案选B。
练习册系列答案
相关题目
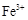 和
和 浓度相等。则已反应的
浓度相等。则已反应的