题目内容
在由Fe、FeO、和Fe2O3组成的混合物中加入100 mL2 mol ·L—1的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况),此时溶液中无Fe3+离子,则下列判断正确的是
| A.混合物里3种物质反应时消耗盐酸的物质的量浓度之比为1︰1︰3 |
| B.反应后所得溶液中的Fe2+离子与Cl-离子的物质的量浓度之比为2︰1 |
| C.混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多 |
| D.混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多 |
C
试题分析:n(Cl-)=0.2mol,反应后的溶液为FeCl2.溶液,n(Fe2+)=0.1mol.所以n(Fe2+):n(Cl-)=1:2可能发生的反应(1)Fe2O3+6HCl=2FeCl3+3H2O; (2)FeO+2HCl=FeCl2+H2O; (3)Fe+2FeCl3=3FeCl2.;(4)Fe+2HCl=FeCl2+H2↑.发生反应产生氢气的铁的物质的量为n(Fe)=0.448L÷22.4mol/L=0.02mol.铁还发生(3)的反应。由(1)(3)可得关系式Fe--2FeCl3--Fe2O3,所以铁的物质的量比Fe2O3的物质的量多。但无法确定氧化亚铁的物质的量的多少。选项为:C。2O3组成的混合物与盐酸反应的知识。

练习册系列答案
相关题目
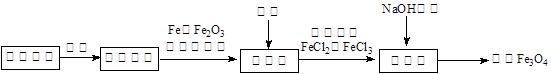
 4Fe3++2H2O
4Fe3++2H2O