题目内容
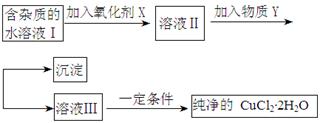
有关FeSO4的转化关系如下图所示(无关物质已略去)。
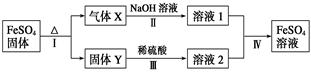
已知:①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色沉淀。
②Y是红棕色的化合物。
(1)气体X的成分是_______________(填化学式),写出通入BaCl2溶液,产生白色沉淀的化学方程式______________________________。
(2)反应Ⅰ的反应类型属于________(填序号)。
a.分解反应 b.复分解反应 c.置换反应 d.化合反应 e.氧化还原反应
(3)溶液2中金属阳离子的检验方法是_____________________________
(4)若经反应Ⅰ得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol·L-1 NaOH溶液完全吸收,则反应Ⅳ中生成FeSO4的离子方程式是_________________

已知:①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色沉淀。
②Y是红棕色的化合物。
(1)气体X的成分是_______________(填化学式),写出通入BaCl2溶液,产生白色沉淀的化学方程式______________________________。
(2)反应Ⅰ的反应类型属于________(填序号)。
a.分解反应 b.复分解反应 c.置换反应 d.化合反应 e.氧化还原反应
(3)溶液2中金属阳离子的检验方法是_____________________________
(4)若经反应Ⅰ得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol·L-1 NaOH溶液完全吸收,则反应Ⅳ中生成FeSO4的离子方程式是_________________
(1)SO2、SO3(2分) SO3+BaCl2+H2O =BaSO4↓+2HCl(3分)
(2)ae(2分)
(3)取少量溶液2于试管中,滴加几滴KSCN溶液,溶液变成血红色,则证明原溶液中含有Fe3+(3分)
(4)2Fe3++SO32-+H2O=2Fe2++SO42-+2H+(3分)
(2)ae(2分)
(3)取少量溶液2于试管中,滴加几滴KSCN溶液,溶液变成血红色,则证明原溶液中含有Fe3+(3分)
(4)2Fe3++SO32-+H2O=2Fe2++SO42-+2H+(3分)
试题分析:
X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色沉淀。确定成分为SO2、SO3;且产生沉淀的方程式为SO3+BaCl2+H2O =BaSO4↓+2HCl;
反应Ⅰ的反应类型属于分解反应、氧化还原反应;
固体Y中铁为+3,溶液2中检验Fe3+取少量溶液2于试管中,滴加几滴KSCN溶液,溶液变成血红色,则证明原溶液中含有Fe3+;
则反应Ⅳ中生成FeSO4的离子方程式为2Fe3++SO32-+H2O=2Fe2++SO42-+2H+。

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案
相关题目
 xH2O)。有如下操作:
xH2O)。有如下操作: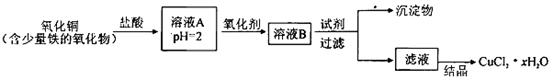
 O2(g)
O2(g) FeO(s) △H=-272 kJ·mol-1
FeO(s) △H=-272 kJ·mol-1  Fe(s)+CO2(g) △H= 。
Fe(s)+CO2(g) △H= 。

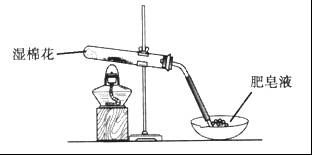
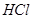 ,并将溶液分装在两支试管中。
,并将溶液分装在两支试管中。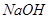 溶液并放置一段时间,该步反应中的实验现象是_________。
溶液并放置一段时间,该步反应中的实验现象是_________。