题目内容
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区分晶体、准晶体和非晶体。
(2) 铁元素位于元素周期表中的第 族,在水溶液中常以Fe2+、Fe3+的形式存在,其中 更稳定。基态Fe原子有________个未成对电子。
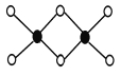
(3)工业上冶炼铝不用氯化铝,因为氯化铝易升华,其双聚物Al2Cl6结构如图所示。1mol该分子中含 个配位键,该分子 (填“是”或“否”)平面型分子。
(4) Fe(CO)5 是一种配位化合物,该物质常温下呈液态,熔点为一20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断:该化合物的晶体中存在的作用力有( )
A.离子键 B.极性键 C.非极性键 D.范德华力 E.氢键 F.配位键
(5)很多金属盐都可以发生焰色反应,其原因是 。
【答案】(1)X射线衍射 (2) Ⅷ Fe3+ 4 (3)2NA 否 (4)BDF
(5)激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长光的形式将能量释放出来
【解析】
试题分析:(1)从外观无法区分三者,但用X光照射挥发现:晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间,因此通过有无衍射现象即可确定;
(2)Fe元素原子核外电子数为26,位于元素周期表第四周期Ⅷ族;根据能量最低原理,其价电子排布式为3d64s2,在周期表中位于第Ⅷ族,Fe3+离子3d为半满稳定状态,能量较低,比较稳定;
(3)Al2Cl6结构中黑色球为Al原子、白色球为Cl原子,Al原子与Cl原子之间形成3个共价键、1个配位键,Al原子杂化轨道数目为4,1mol该分子中含2NA个配位键,该分子不是平面型分子。
(4)该配位化合物常温下呈液态,熔点为一20.5℃,沸点为103℃,易溶于非极性溶剂,这说明该配合物形成的晶体类型是分子晶体,分子之间存在范德华力,C与O之间是极性键,CO与Fe之间还还有配位键,答案选BDF。
(5)由于激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长光的形式将能量释放出来,所以很多金属盐都可以发生焰色反应。