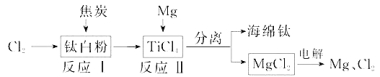
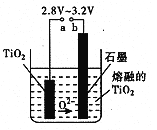
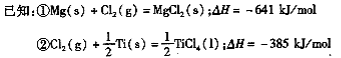题目内容
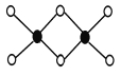
【题目】I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示其中Y所处的周期序数与族序数相等。按要求回答下列问题:


(1)写出X的原子结构示意图_______________。
(2)列举一个事实说明X非金属性强于Z: _______________(用化学方程式表示)
(3)含Y的氯化物呈酸性的原因是__________ (用离子方程式表示)
II.运用所学化学原理,解决下列问题:
(4)已知:Si+2NaOH+H2O=Na2SiO3+2H2。某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为_________________;
(5)已知:①C(s)+ O2(g)= CO2(g)![]() H="a" kJ· mol-1;②CO2(g) +C(s)="2CO(g)"
H="a" kJ· mol-1;②CO2(g) +C(s)="2CO(g)"![]() H="b" kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)
H="b" kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)![]() H="c" kJ· mol-1。工业上生产粗硅的热化学方程式_______________________________;
H="c" kJ· mol-1。工业上生产粗硅的热化学方程式_______________________________;
(6)已知:CO(g)+H2O(g)![]() H2(g) + CO2(g)。右上表为该反应在不同温度时的平衡常数。则:该反应的
H2(g) + CO2(g)。右上表为该反应在不同温度时的平衡常数。则:该反应的![]() H____ 0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为 。
H____ 0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为 。
【答案】(1)![]()
(2)2HNO3+Na2SiO3=2NaNO3+H2SiO3↓
(3)Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
(4)Si-4e-+6OH-=SiO32-+3H2O
(5)2C(s)+SiO2(s)="Si(s)+2CO(g)" △H=(a+b-c)kJ·mol-1
(6)<75%
【解析】试题分析:X为氮,Y为铝,Z为硅,W为氯。(1)X为氮元素,原子结构示意图为;![]()
(2)非金属性越前,其最高价氧化物对应的水化物的酸性越强,所以可以用硝酸制取硅酸即可,方程式为:2HNO3+Na2SiO3=2NaNO3+H2SiO3↓。(3)氯化铝溶液中铝离子水解使溶液显酸性,离子方程式为:Al3++3H2O![]() Al(OH)3+3H+。(4)根据反应分析,硅失去电子生成硅酸根离子,电极反应为:Si-4e-+6OH-=SiO32-+3H2O。(5)根据盖斯定律分析,①+②-③即可得热化学方程式为:2C(s)+SiO2(s)="Si(s)+2CO(g)" △H=(a+b-c)kJ·mol-1。(6)从表分析,温度升高,平衡常数变小,说明升温平衡逆向移动,则正反应为放热反应,△H<0,
Al(OH)3+3H+。(4)根据反应分析,硅失去电子生成硅酸根离子,电极反应为:Si-4e-+6OH-=SiO32-+3H2O。(5)根据盖斯定律分析,①+②-③即可得热化学方程式为:2C(s)+SiO2(s)="Si(s)+2CO(g)" △H=(a+b-c)kJ·mol-1。(6)从表分析,温度升高,平衡常数变小,说明升温平衡逆向移动,则正反应为放热反应,△H<0,
CO(g)+H2O(g)![]() H2(g) + CO2(g)
H2(g) + CO2(g)
起始浓度 1 1 0 0
改变浓度x x x x
平衡浓度 1-x 1-x x x
则有x2/(1-x)2=9,解x=0.75,则一氧化碳的转化率为0.75/1=75%

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案