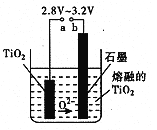
��Ŀ����
����Ŀ���±�Ϊ��ʽ���ڱ���һ���֣����еı�Ŵ�����Ӧ��Ԫ�ء�
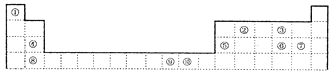
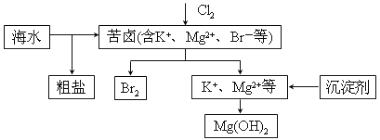
��ش��������⣺
��1��������������Ԫ���γɵ���ԭ�ӷ��ӵĽṹʽΪ_______________________��
��2������������Ԫ���γɵ�������NaOH��Һ��Ӧ�����ӷ���ʽΪ_______________________��
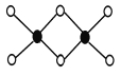
��3����Ԫ����������ԭ�ӹ��ɵ�R���ӿռ乹��Ϊƽ���������Σ�������ӷ���Ϊ________��������ԭ�ӵ��ӻ�����Ϊ_______________________��
��4������˵����ȷ����_______________________��
a���縺�������� b���ۢ���Ԫ�����γɼ��Է���
c���ܢ���Ԫ���γɵĻ�������ֻ�����Ӽ� d��������Ԫ��������������Ϊ2
��5��MԪ�������Ԫ������ͬ����ͬ���ڣ���һ����Ҫ�Ľ���Ԫ�أ���������MԪ�صĺ���ƫ�ͣ����Ӱ��O2�����ڵ��������䡣��֪M2+��CN-��Һ��Ӧ�õ�M(CN)2���������������KCN��Һʱ�����ܽ⣬��������λ�����
���������ܽ���̵Ļ�ѧ����ʽΪ_______________________��
���𰸡���1��![]() ��2��Al2O3+2OH-=2AlO2-+H2O ��3��CH3+ sp2 ��4��bc
��2��Al2O3+2OH-=2AlO2-+H2O ��3��CH3+ sp2 ��4��bc
��5��Fe(CN)2+4KCN=K4[Fe(CN)6]
��������
�����������Ԫ�������ڱ��е�λ�ÿ�֪����ΪH����ΪC����ΪO����ΪMg����ΪAl����ΪS����ΪCl����ΪCa����ΪNi����ΪCu��
��1��������������Ԫ���γɵ���ԭ�ӷ���ΪCCl4����ṹʽΪ![]() ��
��
��2������������Ԫ���γɵ�Al2O3��NaOH��Һ��Ӧ�����ӷ���ʽΪAl2O3+2OH-=2AlO2-+H2O��
��3����Ԫ��C��H��ԭ�ӹ��ɵ�CH3+���ӿռ乹��Ϊƽ���������Σ�������ԭ�ӵ��ӻ�����Ϊsp2��
��4��a�����ķǽ�����̼ǿ�����縺������������a����b��S��O���γ�SO2��SO3�����������SO2�����η����м��ԣ�SO3ƽ��ṹ��Sλ��O���ɵ������������ģ����ԣ���b��ȷ��c��Mg��Cl��Ԫ���γɵĻ�����MgCl2ֻ�����Ӽ�����c��ȷ��d��Ca��Ni��Cu��Ԫ����Ni����������Ϊ1��������Ԫ������������Ϊ2����d����Ϊbc��
��5��MԪ��Ӧ�ù㷺����һ����Ҫ���������Ԫ�أ���������MԪ�صĺ���ƫ�ͣ����Ӱ��O2�����ڵ��������䣬MΪ��Ԫ�أ�Fe(CN)2�ܽ��ڹ�����KCN��Һ�����ɻ�Ѫ�εĻ�ѧʽΪK4[Fe(CN)6]����Ӧ�Ļ�ѧ����ʽΪFe(CN)2+4KCN=K4[Fe(CN)6]��