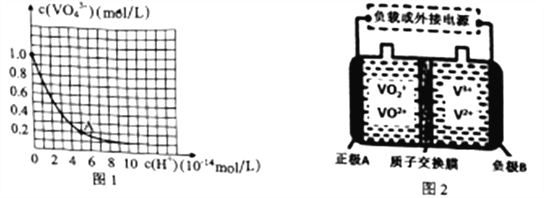
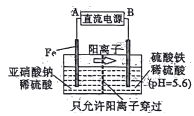
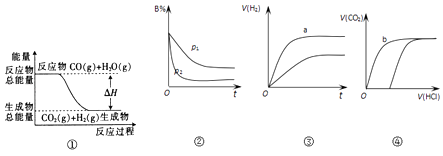
题目内容
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )

A. 溶液中OH﹣向电极b移动
B. O2在电极b上发生还原反应
C. a极的电极反应式为:2NH3﹣6e﹣+ 6OH﹣= N2 + 6H2O
D. 反应消耗的NH3与O2的物质的量之比为4:3
【答案】A
【解析】氨气发生失去电子的氧化反应,氧气发生得到电子的还原反应,据此解答。
氨气发生失去电子的氧化反应,氧气发生得到电子的还原反应,因此a电极是负极,b电极是正极,则
A. 溶液中OH﹣向负极电极a移动,A错误;
B. O2在电极b上发生还原反应,B正确;
C. a极是负极,电解质溶液显碱性,电极反应式为:2NH3﹣6e﹣+6OH﹣=N2 +6H2O,C正确;
D. 1mol氨气失去3个电子,1mol氧气得到4个电子,则根据电子得失守恒可知反应消耗的NH3与O2的物质的量之比为4:3,D正确。
答案选A。

练习册系列答案
相关题目