题目内容
【题目】利用天然气及化工废气中的硫化氢,不仅可制取氢气并回收单质硫,还可减少对环境的污染。
回答下列问题:
(1)在一定的条件下,天然气脱硫工艺中会发生以下反应:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ΔH1
4H2S(g)+SO2(g)=3S2(g)+4H2O(g) ΔH2
2H2S(g)+O2(g)=2S(g)+2H2O(g) ΔH3
则相同条件下反应2S(g)=S2(g)的△H=_______(用含△H1、△H2和△H3的代数式表示)。
(2)硫化氢分解反应2H2S(g)![]() 2H2(g)+S2(g),在101 kPa时各气体的体积分数与温度的关系如下图所示:
2H2(g)+S2(g),在101 kPa时各气体的体积分数与温度的关系如下图所示:

①该反应的△H______0(填“>”、“<”)。
②为提高H2S的平衡分解率,除改变温度外,还可采取的措施是______________________________。
③图中A点时反应的平衡常数Kp=______(用平衡分压代替浓度,平衡分压=总压×物质的量分数)。
(3)我国学者发明的一种分解硫化氢制氢并回收硫的装置如下图所示:
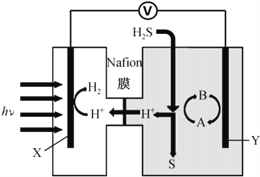
①该装置中能量转化的方式为____________________________________________________。
②若Y极液中的电对(A/B)选用I3-/I-,装置工作时Y极上的电极反应式为__________________________,Y极溶液中发生的离子反应为________________________________;再列举一种可作为Y极循环液常见的电对:_______________。
③该分解H2S制氢的方法主要优点是_____________________________________________________。
【答案】 ![]() (ΔH1+ΔH2)- ΔH3 > 及时将体系中的产物分离(或其他合理答案) 20.2kPa 光能转变为化学能和电能 3I--2e-=I3- I3-+H2S=S↓+2H++ 3I- Fe3+/Fe2+ 充分利用太阳能且不产生污染(或可在常温下实现,操作容易等合理答案))
(ΔH1+ΔH2)- ΔH3 > 及时将体系中的产物分离(或其他合理答案) 20.2kPa 光能转变为化学能和电能 3I--2e-=I3- I3-+H2S=S↓+2H++ 3I- Fe3+/Fe2+ 充分利用太阳能且不产生污染(或可在常温下实现,操作容易等合理答案))
【解析】(1)根据守恒原理,要得到方程式④,可以用![]() ,则
,则![]() (ΔH1+ΔH2)- ΔH3。答案为:
(ΔH1+ΔH2)- ΔH3。答案为:![]() (ΔH1+ΔH2)- ΔH3
(ΔH1+ΔH2)- ΔH3
(2)①根据图示,随着温度的升高,反应物H2S的体积分数逐渐减少,说明平衡向正反应方向移动,升温平衡向吸热方向进行,则△H> 0。
②为提高H2S的平衡分解率,除改变温度外,还可采取的措施是及时将体系中的产物分离、适当减小压强等。
③设H2S起始的物质的量浓度为![]() ,A点时
,A点时![]() 与
与![]() 的浓度相同,设为
的浓度相同,设为![]() ,则
,则
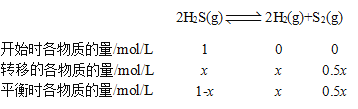
,则有![]() ,解得
,解得![]() ,
,![]()
答案为: >、及时将体系中的产物分离、20.2kPa
(3)①该装置是将光能转变为化学能和电能。②X电极是将H+转化为H2,化合价降低,发生还原反应,则Y电极应发生氧化反应,反应式为3I--2e-=I3-;Y极溶液中有H2S具有还原性,而I3-具有氧化性,则两者可以发生氧化还原反应,离子反应为I3-+H2S=S↓+2H++ 3I-;另一种可作为Y极循环液常见的电对Fe3+/Fe2+。③该分解H2S制氢的方法主要优点是充分利用太阳能且无污染、可在常温下实现、操作容易等。答案为:光能转变为化学能和电能 、3I--2e-=I3- 、I3-+H2S=S↓+2H++ 3I- 、Fe3+/Fe2+ 、充分利用太阳能且不产生污染(或可在常温下实现,操作容易等合理答案))

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案