题目内容
【题目】工业上用电解法可用于治理亚硝酸盐对水体的污染,模拟工艺如图所示,下列说法不正确的是
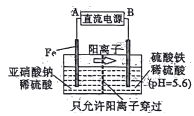
A. A、B分别为直流电源的正极和负极
B. 研究表明,当右侧区域pH较小时,会有气体逸出,该现象说明H+的氧化性强弱与其c(H+)有关
C. 电解过程中,左侧区域将依次发生反应为:Fe-2e-=Fe2+ 2NO2-+8H++6Fe2+=N2↑+6Fe3++4H2O
D. 当电解过程转移0.6mol电子时,左侧区域质量减少1.4g
【答案】D
【解析】根据装置图中阳离子的移动方向可知,左侧区域是阳极室,右侧区域为阴极室,A为直流电源的正极,B为直流电源的负极,故A正确;B. 当右侧区域pH较小时,会有气体逸出,是H+优先Fe3+放电的结果,说明c(H+)越大,H+的氧化性越强,故B正确;C. Fe电极是阳极,属于活性电极,Fe失电子,电极反应式为:Fe-2e-=Fe2+,在酸性条件下Fe2+将NO2-还原成N2,离子方程式为:2NO2-+8H++6Fe2+=N2↑+6Fe3++4H2O,达到去除NO2-的污染问题,故C正确;D. 当电解过程转移0.6mol电子时,阳极生成0.3mol Fe2+,还原0.1mol NO2-生成1.4gN2,除此之外还有部分阳离子通过离子交换膜移到右侧区域,导致左侧区域质量变化无法计算,故D错误;答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目