题目内容
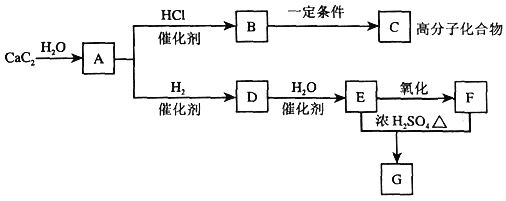
【题目】用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c)、v(b)>v(d)
C.平衡常数:K(a)>K(c)、K(b)>K(d)
D.平均摩尔质量:M(a)>M(c)、M(b)>M(d)
【答案】D
【解析】
A. 该反应为放热反应,温度越低,CO的转化率越大,则T1<T2<T3,故A错误;
B. 由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,温度越低,CO的转化率越大,故温度T1<T3,温度越高,反应速率越快,故υ(a)<υ(c);b、d两点温度相同,压强越大,反应速率越大,b点大于d点压强,则v(b)>v(d),故B错误;
C. 由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,故温度T1<T3,降低温度平衡向正反应方向移动,则K(a)>K(c),平衡常数只与温度有关,b、d两点温度相同,平衡常数相同,则K(b)=K(d),故C错误;
D. CO转化率的越大,n总越小,由M=m÷n可知,a点n总小,则M(a)>M(c),M(b)>M(d),故D正确;
故选:C。

 阅读快车系列答案
阅读快车系列答案【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是
A. 此时刻正反应速率大于逆反应速率
B. 若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率增大
C. 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
D. a=1.64
【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应![]() 为放热反应:
为放热反应:
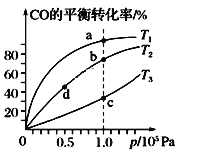
①下图能正确表示该反应中能量变化的是______;
②根据下表数据,计算生成1mol![]() 时该反应放出的热量为______kJ;
时该反应放出的热量为______kJ;
化学键 |
|
|
|
断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3mol![]() 和1mol
和1mol![]() 通入容积为2L的密闭容器中发生反应,5min达到平衡,测得
通入容积为2L的密闭容器中发生反应,5min达到平衡,测得![]() ,则0至5min时
,则0至5min时![]() ______,达到平衡时
______,达到平衡时![]() 的转化率为______。
的转化率为______。
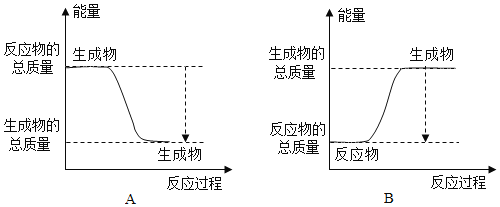
(2)某兴趣小组为研究原电池原理,设计如图装置。
①![]() 和b用导线连接,Cu极为原电池______极
和b用导线连接,Cu极为原电池______极![]() 填“正”或“负”
填“正”或“负”![]() ,电极反应式是:______;
,电极反应式是:______;
Al极发生______![]() 填“氧化”或“还原”
填“氧化”或“还原”![]() 反应,其电极反应式为:______,溶液中
反应,其电极反应式为:______,溶液中![]() 移向______。
移向______。![]() 填“Cu”或“Al”极
填“Cu”或“Al”极![]() 溶液pH______
溶液pH______![]() 填增大或减小
填增大或减小![]() ;当负极金属溶解
;当负极金属溶解![]() 时,______
时,______![]() 电子通过导线。
电子通过导线。
②不将a、b连接,请问如何加快Al与稀硫酸的反应速率?______