题目内容
【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应![]() 为放热反应:
为放热反应:
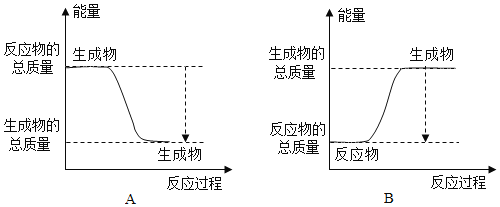
①下图能正确表示该反应中能量变化的是______;
②根据下表数据,计算生成1mol![]() 时该反应放出的热量为______kJ;
时该反应放出的热量为______kJ;
化学键 |
|
|
|
断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3mol![]() 和1mol
和1mol![]() 通入容积为2L的密闭容器中发生反应,5min达到平衡,测得
通入容积为2L的密闭容器中发生反应,5min达到平衡,测得![]() ,则0至5min时
,则0至5min时![]() ______,达到平衡时
______,达到平衡时![]() 的转化率为______。
的转化率为______。
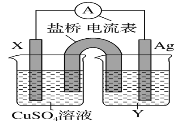
(2)某兴趣小组为研究原电池原理,设计如图装置。
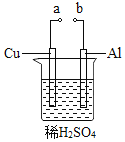
①![]() 和b用导线连接,Cu极为原电池______极
和b用导线连接,Cu极为原电池______极![]() 填“正”或“负”
填“正”或“负”![]() ,电极反应式是:______;
,电极反应式是:______;
Al极发生______![]() 填“氧化”或“还原”
填“氧化”或“还原”![]() 反应,其电极反应式为:______,溶液中
反应,其电极反应式为:______,溶液中![]() 移向______。
移向______。![]() 填“Cu”或“Al”极
填“Cu”或“Al”极![]() 溶液pH______
溶液pH______![]() 填增大或减小
填增大或减小![]() ;当负极金属溶解
;当负极金属溶解![]() 时,______
时,______![]() 电子通过导线。
电子通过导线。
②不将a、b连接,请问如何加快Al与稀硫酸的反应速率?______
【答案】A 46 0.06 ![]()
![]() 正
正 ![]() 氧化
氧化 ![]() Al 增大
Al 增大 ![]() 往溶液里滴入少量硫酸铜溶液;或将铜棒直接靠在铝棒上。
往溶液里滴入少量硫酸铜溶液;或将铜棒直接靠在铝棒上。
【解析】
![]() 反应
反应![]() 为放热反应,反应物的总能量大于生成物的总能量,由此分析解答;
为放热反应,反应物的总能量大于生成物的总能量,由此分析解答;
![]() 反应物的总键能减去生成物的总键能
反应物的总键能减去生成物的总键能![]() 反应焓变,结合热化学方程式定量关系计算生成
反应焓变,结合热化学方程式定量关系计算生成![]() 时该反应放出的热量;
时该反应放出的热量;
![]() 结合化学反应三行计算列式,反应速率
结合化学反应三行计算列式,反应速率![]() ,转化率
,转化率![]() ;
;
![]() 该装置构成原电池,锌易失电子作负极、Cu作正极,负极电极反应为
该装置构成原电池,锌易失电子作负极、Cu作正极,负极电极反应为![]() 、正极反应为
、正极反应为![]() ,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动;根据锌和转移电子之间的关系式计算;
,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动;根据锌和转移电子之间的关系式计算;
![]() 加入硫酸铜溶液发生置换反应生成铜附着在铝片上在稀硫酸中形成原电池反应。
加入硫酸铜溶液发生置换反应生成铜附着在铝片上在稀硫酸中形成原电池反应。
![]() 反应
反应![]() 为放热反应,反应物的总能量大于生成物的总能量,所以图A符合,故选:A,故答案为:A;
为放热反应,反应物的总能量大于生成物的总能量,所以图A符合,故选:A,故答案为:A;
![]() 反应
反应![]() 的焓变
的焓变![]() ,反应生成2mol氨气放热92KJ,生成
,反应生成2mol氨气放热92KJ,生成![]() 时该反应放出的热量为46KJ,故答案为:46;
时该反应放出的热量为46KJ,故答案为:46;
![]() 一定温度下,将
一定温度下,将![]() 和
和![]() 通入容积为2L的密闭容器中发生反应,5min达到平衡,测得
通入容积为2L的密闭容器中发生反应,5min达到平衡,测得![]() ,
,

则0至5min时![]() ,
,
平衡时![]() 的转化率
的转化率![]() ,
,
故答案为:![]() ;
;![]() ;
;
![]() 该装置为原电池,锌易失电子作负极、Cu作正极,正极上氢离子放电,电极反应为
该装置为原电池,锌易失电子作负极、Cu作正极,正极上氢离子放电,电极反应为![]() ,铝失电子发生氧化反应,电极反应为:
,铝失电子发生氧化反应,电极反应为:![]() ,电解质溶液中硫酸根离子向负极Al极移动,溶液中消耗氢离子,溶液PH增大,当负极金属溶解
,电解质溶液中硫酸根离子向负极Al极移动,溶液中消耗氢离子,溶液PH增大,当负极金属溶解![]() 时,溶解的铝物质的量
时,溶解的铝物质的量![]() ,结合电极反应
,结合电极反应![]() ,计算得到电子转移总数
,计算得到电子转移总数![]() 即为
即为![]() ,故答案为:正;
,故答案为:正;![]() ;氧化;
;氧化;![]() ;Al;增大;
;Al;增大;![]() ;
;
![]() 不将a、b连接,加快Al与稀硫酸的反应速率的方法:往溶液里滴入少量硫酸铜溶液;或将铜棒直接靠在铝棒上形成原电池反应加快反应速率,答:往溶液里滴入少量硫酸铜溶液;或将铜棒直接靠在铝棒上。
不将a、b连接,加快Al与稀硫酸的反应速率的方法:往溶液里滴入少量硫酸铜溶液;或将铜棒直接靠在铝棒上形成原电池反应加快反应速率,答:往溶液里滴入少量硫酸铜溶液;或将铜棒直接靠在铝棒上。

【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.软锰矿(MnO2)、菱锰矿(MnCO3)吸收烧结烟气中的SO2制取硫酸锰。pH值对SO2吸收率的影响如图所示。在吸收过程中,氧气溶解在矿浆中将 H2SO3氧化成硫酸。

(1)SO2的吸收率在pH=_____效果最佳,MnO2所起的作用是_______,菱锰矿作为调控剂与硫酸反应, 确保pH的稳定,该反应的化学方程式为___________。
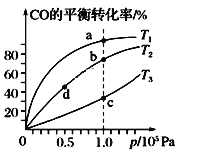
Ⅱ.沥青混凝土可作为2CO(g)+O2(g)![]() 2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。

(2)CO转化反应的平衡常数K(a)____K(c)(填“>”“<”或“=”,下同),在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率___α型,e点转化率出现突变的原因可能是______。
Ⅲ.N2H4是一种具有强还原性的物质。燃烧过程中释放的能量如下:(已知a>b)
① N2H4(g)+2O2(g) == NO2(g)+1/2N2(g)+2H2O(g) ΔH1=a kJ·mol-1
② N2H4(g)+2O2(g) == 2NO(g)+2H2O(g) ΔH2=b kJ·mol-1
(3)已知反应活化能越低,反应速率越大。假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是______。


(4)试写出NO(g)分解生成N2(g)和NO2(g)的热化学方程式为_____________。
Ⅳ.某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如下图所示。
模拟尾气 | 气体(10mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | n |
(5)375℃时,测得排出的气体中含0.45 molO2和0.0525mol CO2,则Y的化学式为_____。实验过程中不采用NO2的模拟NOx原因是_________。

【题目】在一定条件下有反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ/mol.现有容积相同的甲、乙、丙三个定容容器。在上述条件下分别充入的气体和反应放出的热量(Q)如表所示:
2SO3(g) △H=-197kJ/mol.现有容积相同的甲、乙、丙三个定容容器。在上述条件下分别充入的气体和反应放出的热量(Q)如表所示:
容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ) |
甲 | 2 | 1 | 0 | Q1 |
乙 | 1 | 0.5 | 0 | Q2 |
丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述不正确的是:
A. Q1<197
B. 在上述条件下,反应生成1molS03气体放热98.5kJ
C. Q2=Q3
D. Q3<Q1<2Q2