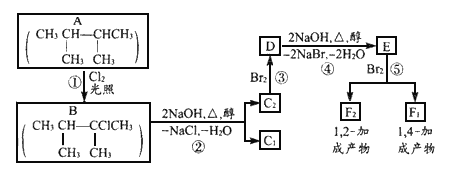
题目内容
【题目】有下列三个反应:①2FeCl3+2KI===2FeCl2+2KCl+I2,②2Fe+3Cl2![]() 2FeCl3,③2KMnO4+16HCl(浓)===2KCl+2MnCl2+8H2O+5Cl2↑,若某溶液中有Fe2+、I和Cl,要氧化除去I而不除去Fe2+和Cl,可加入的试剂是
2FeCl3,③2KMnO4+16HCl(浓)===2KCl+2MnCl2+8H2O+5Cl2↑,若某溶液中有Fe2+、I和Cl,要氧化除去I而不除去Fe2+和Cl,可加入的试剂是
A. Cl2B. KMnO4C. FeCl3D. HCl
【答案】C
【解析】
氧化剂的氧化性大于氧化产物,由反应①②③可知氧化性由强至弱的顺序为:MnO4->Cl2>Fe3+>I2,还原性由强至弱的顺序为I->Fe2+>Cl->Mn2+。
A项、氯气能将Fe2+、I-均氧化,故A错误;
B项、KMnO4能将Fe2+、I-和Cl-均氧化,故B错误;
C项、FeCl3能氧化除去I-而不影响Fe2+和Cl-,故C正确;
D项、HCl与Fe2+、I和Cl三种离子均不反应,故D错误;
故选C。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案【题目】化学反应原理是研究和学习化学的重要依据。回答下列问题:
(1)已知氢气的燃烧热△H=﹣285.5kJmol﹣1,则电解水的热化学方程式为_____
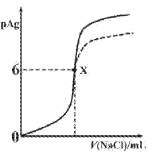
(2)在298K、101kPa下,2SO2(g)+O2(g)2SO3(g)△H=﹣198kJmol﹣1,则相同条件下,2mol SO2和 1 mol O2充分反应,最终放出的热量_____198kJ(填“大于”“小于或“等于”);该反应的平衡常数表达式K=_____。
(3)25℃时,下表为一些难溶电解质的相关数据:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
开始沉淀时的pH | 5.8 | 4.1 | 2.0 |
完全沉淀时的pH | 8.3 | 6.4 | 3.2 |
常温下,除去酸性CuCl2溶液中含有的少量FeCl2,其操作步骤为:
①应先加入_____(填试剂名称),发生的离子反应方程式为_____
②再加入CuO,调节溶液的pH在_____范围内,使溶液中的Fe3+转化为Fe(OH)3沉淀,过滤。