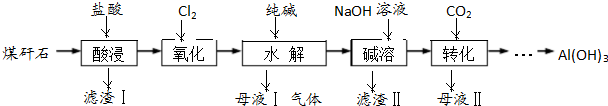
题目内容
15.阿司匹林能迅速解热、镇痛.长效缓释阿司匹林可在体内逐步水解而疗效更佳.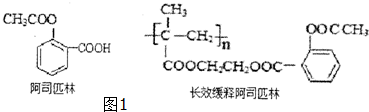
用丙酮为主要原料合成长效缓释阿司匹林的流程如图.
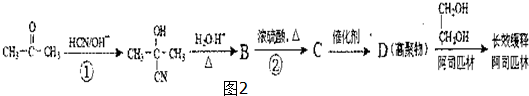
已知:
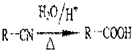 ,回答问题:
,回答问题:(1)B含有的官能团的名称是羟基和羧基,反应②的反应类型为消去反应.
(2)下列有关阿司匹林的叙述正确的是CD(填选项编号).
A.属于芳香烃
B.分子式为C9H10O4
C.能与NaHCO3溶液反应生成无色气体
D.在酸性条件下水解生成的产物之一可使FeCl3溶液显紫色
(3)D的结构简式
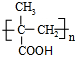 .
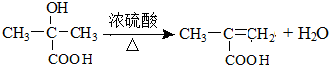
.(4)写出B→C反应的化学方程式
 .
.(5)有机物A是阿司匹林的同分异构体,具有如下特征:
①苯环含有对二取代结构;
②能发生银镜反应;
③能发生水解反应且产物中的2种为同系物或同种物质.
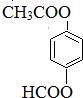
写出A的结构简式
 (只写一种).
(只写一种).
分析 根据题中各物质的转化关系可知,丙酮与HCN在碱性条件下发生加成反应生成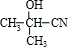 ,再发生水解反应得到B为(CH3)2C(OH)COOH,B发生消去反应得到C为CH2=C(CH3)COOH,C发生加聚反应得到聚合物D为
,再发生水解反应得到B为(CH3)2C(OH)COOH,B发生消去反应得到C为CH2=C(CH3)COOH,C发生加聚反应得到聚合物D为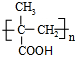 ,据此答题.
,据此答题.
解答 解:根据题中各物质的转化关系可知,丙酮与HCN在碱性条件下发生加成反应生成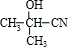 ,再发生水解反应得到B为(CH3)2C(OH)COOH,B发生消去反应得到C为CH2=C(CH3)COOH,C发生加聚反应得到聚合物D为
,再发生水解反应得到B为(CH3)2C(OH)COOH,B发生消去反应得到C为CH2=C(CH3)COOH,C发生加聚反应得到聚合物D为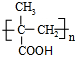 ,
,
(1)根据上面的分析可知,B为(CH3)2C(OH)COOH,含有的官能团为羟基和羧基,反应②为消去反应,
故答案为:羟基和羧基;消去反应;
(2)根据阿司匹林的结构简式可知,
A.阿司匹林中有氧元素,所以不属于芳香烃,故A错误;
B.阿司匹林的分子式为C9H8O4,故B错误;
C.阿司匹林中有羧基,所以能与NaHCO3溶液反应生成无色气体二氧化碳,故C正确;
D.在酸性条件下水解生成酚羟基,可使三氯化铁溶液溶液显紫色,故D正确,
故答案为:CD;
(3)根据上面的分析可知,D的结构简式为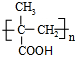 ,故答案为:
,故答案为: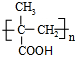 ;
;
(4)B→C反应的化学方程式为 ,
,
故答案为: ;
;
(5)有机物A是阿司匹林的同分异构体,具有如下特征:①苯环含有对二取代结构②能发生银镜反应,说明有醛基,③能发生水解反应且产物中的2种为同系物或同种物质,符合这样条件的有机物为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物的推断与合成,根据阿司匹林与长效缓释阿司匹林的结构推断D的结构是解题的关键,注意对反应信息的利用,需要学生根据转化关系判断,注重对学生的自学能力、理解能力、分析归纳能力、知识迁移能力的考查.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
6.实验室里需用道480mL0.1mol/L的硫酸铜溶液,以下配制溶液的操作正确的是( )
| A. | 称取7.6g硫酸铜,加入500 mL的水 | B. | 称取8.0g硫酸铜,配成500mL溶液 | ||
| C. | 称取12.0g胆矾,配成500mL溶液 | D. | 称取12.5g胆矾,加入500mL水 |
3.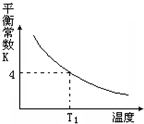 T℃时,将1molX和2molY投入2L的密闭容器中,发生反应X(g)+Y(g)?2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图.则下列判断正确的是( )
T℃时,将1molX和2molY投入2L的密闭容器中,发生反应X(g)+Y(g)?2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图.则下列判断正确的是( )
 T℃时,将1molX和2molY投入2L的密闭容器中,发生反应X(g)+Y(g)?2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图.则下列判断正确的是( )
T℃时,将1molX和2molY投入2L的密闭容器中,发生反应X(g)+Y(g)?2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图.则下列判断正确的是( )| 0 | 1 | 2 | 3 | 4 | 5 | 6 | |
| X | 1 | 0.80 | 0.66 | 0.58 | 0.52 | 0.50 | 0.50 |
| Y | 2 | 1.80 | 1.66 | … | … | … | … |
| A. | 前5min用Z表示的平均反应速率为0.2 mol/(L•min) | |
| B. | 该反应的正反应是吸热反应,且T1>T | |
| C. | 若温度为T1时,以同样的起始量反应,达到平衡时X的转化率约为66.7% | |
| D. | 在T℃时,以1molX、2molY和1molZ充入上述容器中,达到平衡时,X的转化率仍为50% |
20. 甲醇是重要的化工原料,在化工生产中有广泛的应用.
甲醇是重要的化工原料,在化工生产中有广泛的应用.
(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢反应生成H2和甲酸甲酯(HCOOCH3)、再分解生成CO和CH3OH.写出相应反应的化学方程式:2CH3OH→HCOOCH3+2H2↑、HCOOCH3→CH3OH+CO↑.
(2)利用太阳能或生物质能分解水制H2,然后可将H2与C02转化为甲醇.已知:
光催化制氢:2H2O(1)=2H2(g)+O2(g)△H=+571.5kJ•mol-1
H2与C02耦合反应:3H2(g)十CO2(g)=CH3OH(1)+H2O(1)△H=一137.8kJ•mol-1
则反应:2H2O(1)+CO2(g)=CH30H(l)+3/202(g)的△H=+719.45 kJ•mol-1
(3)已知反应:CO(g)+2H2(g)?CH3OH(g)△H=Q
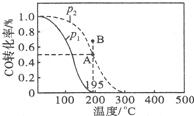
在20L的密闭容器中,按物质的量之比1:2充入CO和H2,测得CO的转化率随温度及压强的变化如图所示,P2及195℃时n(H2)随时间的变化如表所示:
①O~3min,平均速率V(CH3OH)=0.033mol/(L.min),Q<0(填“<”“=”或“>”).
②图中压强(P1、P2)的大小顺序为P1<P2,理由是相同温度下,压强P2平衡时CO的转化率更大,而正反应为气体体积减小的反应,增大压强平衡向正反应方向移动,CO的转化率提高.
③在P2及195℃时,该反应的平衡常数K=25.
 甲醇是重要的化工原料,在化工生产中有广泛的应用.
甲醇是重要的化工原料,在化工生产中有广泛的应用.(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢反应生成H2和甲酸甲酯(HCOOCH3)、再分解生成CO和CH3OH.写出相应反应的化学方程式:2CH3OH→HCOOCH3+2H2↑、HCOOCH3→CH3OH+CO↑.
(2)利用太阳能或生物质能分解水制H2,然后可将H2与C02转化为甲醇.已知:
光催化制氢:2H2O(1)=2H2(g)+O2(g)△H=+571.5kJ•mol-1
H2与C02耦合反应:3H2(g)十CO2(g)=CH3OH(1)+H2O(1)△H=一137.8kJ•mol-1
则反应:2H2O(1)+CO2(g)=CH30H(l)+3/202(g)的△H=+719.45 kJ•mol-1
(3)已知反应:CO(g)+2H2(g)?CH3OH(g)△H=Q
在20L的密闭容器中,按物质的量之比1:2充入CO和H2,测得CO的转化率随温度及压强的变化如图所示,P2及195℃时n(H2)随时间的变化如表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
②图中压强(P1、P2)的大小顺序为P1<P2,理由是相同温度下,压强P2平衡时CO的转化率更大,而正反应为气体体积减小的反应,增大压强平衡向正反应方向移动,CO的转化率提高.
③在P2及195℃时,该反应的平衡常数K=25.
7.下列说法正确的是( )
| A. | 按系统命名法,化合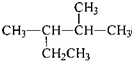 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 | |
| B. | 甲醇、乙醇、甘油互为同系物 | |
| C. | 等物质的量的乙炔、乙醛,完全燃烧时的耗氧量不相等 | |
| D. | 以乙烯为原料制备乙酸乙酯的合成路线可以为: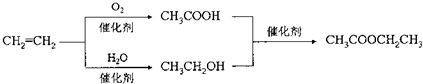 |
4.一种高容量的固态锂电池以锂超离子固态导体(组成为Li30GeP2S12)为电解质,该锂电池能在-100℃至100℃之间的超宽温度范围内工作.下列说法不正确的是( )
| A. | Li的原子结构示意图为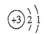 | B. | 原子半径:P>S | ||
| C. | 酸性:H3PO4<H2SO4 | D. | Li、Ge、P、S都属于短周期元素 |
5.一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )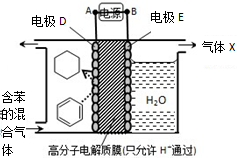

| A. | 电极D的电极反应式为C6H6+6H++6e-=C6H12 | |
| B. | 气体X在反应中通常体现还原性 | |
| C. | 电极D为惰性电极,E为活泼电极 | |
| D. | 外电路电子的移动方向:A→电极→B |
 .
.