题目内容
【题目】C、S和Cl元素的单质及化合物在工业生产中的有效利用备受关注。请回答下列问题:
(1)已知:Ⅰ.2SO2(g)+O2(g)+2H2O(l)=2H2SO4(aq)ΔH1;
Ⅱ.Cl2(g)+H2O(l)![]() HCl(aq)+HClO(aq)ΔH2;
HCl(aq)+HClO(aq)ΔH2;
Ⅲ.2HClO(aq)=2HCl(aq)+O2(g)ΔH3;
SO2(g)+Cl2(g)+2H2O(l)=2HCl(aq)+H2SO4(aq)
ΔH4=____________________(用含有ΔH1、ΔH2和ΔH3的代数式表示)。
(2)25℃时,H2SO3溶液中各含硫微粒的物质的量分数(δ)与溶液pH的变化关系如图甲所示。
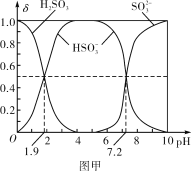
已知25℃时,NaHSO3的水溶液pH<7,用图中的数据通过计算解释原因_____________________________________________________。
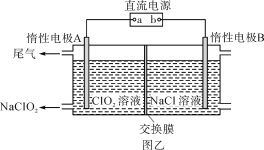
(3)NaClO2是一种绿色消毒剂和漂白剂,工业上采用电解法制备NaClO2的原理如图乙所示。
①交换膜应选用____________________(填“阳离子交换膜”或“阴离子交换膜”)。
②阳极的电极反应式为_____________________________________。
(4)一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,发生反应2CO(g)+SO2(g)![]() S(l)+2CO2(g)ΔH=-270kJ/mol,若反应进行到20min时达到平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)=______________,该温度下化学平衡常数K=____________(L·mol-1)
S(l)+2CO2(g)ΔH=-270kJ/mol,若反应进行到20min时达到平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)=______________,该温度下化学平衡常数K=____________(L·mol-1)
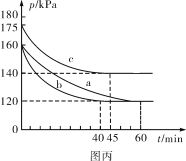
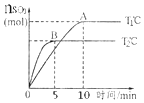
(5)在不同条件下,向2L恒容密闭容器中通入2molCO和1molSO2,反应体系总压强随时间的变化如图丙所示:
①图丙中三组实验从反应开始至达到平衡时,v(CO)最大的为__________(填字母序号)。
②与实验a相比,c组改变的实验条件可能是_____________________________________。
【答案】![]() 由图中数据可以计算出Ka2(H2SO3)=10-7.2,Ka1(H2SO3)=10-1.9,
由图中数据可以计算出Ka2(H2SO3)=10-7.2,Ka1(H2SO3)=10-1.9,![]() 的水解常数是10-12.1,
的水解常数是10-12.1,![]() 电离程度大于水解程度,溶液显酸性 阳离子交换膜 2Cl--2e-===Cl2↑ 0.03mol·L-1·min-1 11.25 b 升高温度
电离程度大于水解程度,溶液显酸性 阳离子交换膜 2Cl--2e-===Cl2↑ 0.03mol·L-1·min-1 11.25 b 升高温度
【解析】
(1)利用盖斯定律同向相加,异向相减的原则计算ΔH4=![]() ;
;
(2)根据图像pH=1.9时,Ka1(H2SO3)=![]() =10-1.9,则HSO3-的水解平衡常数Kh=
=10-1.9,则HSO3-的水解平衡常数Kh=![]() =10-12.1,根据pH=7.2,计算Ka2=c(H+)=10-7.2,然后比较
=10-12.1,根据pH=7.2,计算Ka2=c(H+)=10-7.2,然后比较![]() 电离程度与HSO3-的水解程度的大小,确定溶液酸碱性;
电离程度与HSO3-的水解程度的大小,确定溶液酸碱性;
(3)分析图像中的反应物和产物,可以看出左侧由ClO2制备NaClO2,需要Na+从右侧到左侧,所以判定交换膜为阳离子交换膜;
(4)根据已知条件,列“三段式”:根据平衡时CO的体积分数,计算出平衡CO、SO2、CO2的物质的量浓度,计算出平衡常数;
(5)根据反应前后单位时间内总压强的变化,比较反应速率的快慢。
(1)Ⅰ.2SO2(g)+O2(g)+2H2O(l)=2H2SO4(aq)ΔH1;Ⅱ.Cl2(g)+H2O(l)![]() HCl(aq)+HClO(aq) ΔH2;Ⅲ.2HClO(aq)=2HCl(aq)+O2(g) ΔH3;由盖斯定律:
HCl(aq)+HClO(aq) ΔH2;Ⅲ.2HClO(aq)=2HCl(aq)+O2(g) ΔH3;由盖斯定律:![]() ×(Ⅰ+Ⅱ×2+Ⅲ) 得,SO2(g)+Cl2(g)+2H2O(l)=2HCl(aq)+H2SO4(aq) ΔH4=
×(Ⅰ+Ⅱ×2+Ⅲ) 得,SO2(g)+Cl2(g)+2H2O(l)=2HCl(aq)+H2SO4(aq) ΔH4=![]() ;
;
(2)由图中的数据计算的H2SO3电离平衡常数Ka1、Ka2,当pH=7.2时,c(HSO3-)=c(SO32-),Ka2=![]() =c(H+)=10-7.2;当pH=1.9时,c(HSO3-)=c(H2SO3),Ka1=
=c(H+)=10-7.2;当pH=1.9时,c(HSO3-)=c(H2SO3),Ka1=![]() =10-1.9,所以HSO3-的水解平衡常数= Kh=
=10-1.9,所以HSO3-的水解平衡常数= Kh=![]() =10-12.1
=10-12.1![]() 电离程度大于水解程度,NaHSO3的水溶液显酸性,NaHSO3溶液的pH<7;
电离程度大于水解程度,NaHSO3的水溶液显酸性,NaHSO3溶液的pH<7;
(3)①由ClO2 →NaClO2可知,氯元素的化合价降低,所以ClO2得到电子发生还原反应,即A电极为阴极,电极反应式为ClO2 +e-=ClO2-,ClO2-结合Na+生成NaClO2,所以Na+由阳极区移向阴极区,则离子交换膜为阳离子交换膜;
②阳极区Cl-失去电子生成氯气,电极反应式为2Cl--2e-===Cl2↑;
(4)令反应中二氧化硫的变化量为x mol/L,根据化学方程式方程式,列出反应的三段式:
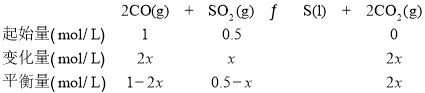
由于二氧化碳的体积分数为0.5,则![]() ,x=0.3,所以v(CO)=
,x=0.3,所以v(CO)=![]() =0.03mol·L-1·min-1;平衡常数:
=0.03mol·L-1·min-1;平衡常数:![]() ;
;
(5)①实验c由175kPa起始,达到平衡所需时间为455min,实验a与实验b相比,所以b达到平衡所用的时间更短,单位时间内总压强的变化分别为,实验b:
![]() ,实验c:
,实验c:![]() ,所以实验b的反应速率更快,即v(CO)最大的为b;
,所以实验b的反应速率更快,即v(CO)最大的为b;
②与实验a相比,实验c达到平衡所需时间更短,所以速率加快,根据反应方程式2CO(g)+SO2(g)![]() S(l)+2CO2(g)ΔH=-270kJ/mol,改变条件后,压强增大,说明平衡向逆反应方向移动,因为该反应的正反应是放热反应,故改变的条件可能是升高温度。
S(l)+2CO2(g)ΔH=-270kJ/mol,改变条件后,压强增大,说明平衡向逆反应方向移动,因为该反应的正反应是放热反应,故改变的条件可能是升高温度。
【点晴】
在比较弱酸的酸式盐的溶液呈酸性或碱性时,考生应结合题中图像信息,找到关键的几个特殊点,计算出电离平衡常数和水解平衡常数,如果弱酸的酸式根离子的电离平衡常数大于弱酸的酸式根离子的水解平衡常数,则溶液呈酸性;若弱酸的酸式根离子的电离平衡常数小于弱酸的酸式根离子的水解平衡常数,则溶液呈碱性。

 阅读快车系列答案
阅读快车系列答案