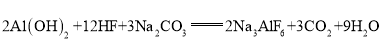题目内容
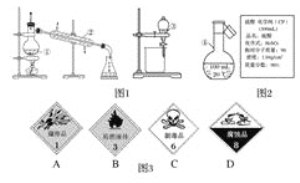
【题目】实验室用化合物A模拟工业上制备含氧酸D的过程如图所示,已知D为强酸,请回答下列问题。
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了_____而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体。
①A的化学式是_________;C的化学式是_______。
②D的浓溶液在常温下可与铜反应并生成C气体,反应的化学方程式是____,该反应______(填“属于”或“不属于”)氧化还原反应。
【答案】H2SO4 酸雨 NH3 NO2 Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 属于
【解析】
(1)若B是能使品红溶液褪色的有刺激性气味的无色气体,则其为二氧化硫。
①由B可推出C,进而推出D;
②在工业生产中,B气体的大量排放被雨水吸收,生成亚硫酸和硫酸而污染环境。
(2)若C是红棕色的气体,则其为二氧化氮。
①由C可逆推出A。
②由C可推出D为硝酸,浓硝酸在常温下可与铜反应并生成二氧化氮气体,由此可写出反应的化学方程式,并可分析该反应是否为氧化还原反应。
(1)若B是能使品红溶液褪色的有刺激气味的无色气体,则B为二氧化硫,C为三氧化硫,D为硫酸。
①D的化学式是H2SO4;答案为:H2SO4;
②在工业生产中,B气体的大量排放被雨水吸收后形成了酸雨而污染环境。答案为:酸雨;
(2)若C是红棕色气体,则C为二氧化氮,B为一氧化氮,A为氨气,D为硝酸。
①A的化学式是NH3;C的化学式是NO2。答案为:NH3;NO2;
②由C可推出D为硝酸,浓硝酸在常温下可与铜反应并生成二氧化氮气体,反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,在该反应中,Cu、N两元素的化合价发生了变化,所以该反应属于氧化还原反应。答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;属于。