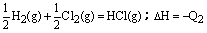题目内容
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+ 4 NO2 (g)= 4 NO(g)+ CO2 (g)+ 2 H2O(g)ΔH= -574 kJ · mol-1
CH4(g)+ 4 NO(g)= 2 N2(g)+ CO2 (g)+ 2 H2O(g)ΔH= -1160 kJ· mol-1
(1)若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为
(阿伏加德罗常数的值用NA表示),放出的热量为 kJ。
(2)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式_______________________________。
(3)甲硅烷(SiH4)是一种无色液体,遇到空气能发生爆炸性自燃,生成(SiO2)和水。已知室
温下10 g甲硅烷自燃放出热量446 kJ,表示其燃烧热的热化学方程式为:
________________________________________________________________________。
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1 mol Cl2参与反应时释放145 kJ的热量,写出这个反应的热化学方程式:
_________________________________________________________________________。
CH4(g)+ 4 NO2 (g)= 4 NO(g)+ CO2 (g)+ 2 H2O(g)ΔH= -574 kJ · mol-1
CH4(g)+ 4 NO(g)= 2 N2(g)+ CO2 (g)+ 2 H2O(g)ΔH= -1160 kJ· mol-1
(1)若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为
(阿伏加德罗常数的值用NA表示),放出的热量为 kJ。
(2)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式_______________________________。
(3)甲硅烷(SiH4)是一种无色液体,遇到空气能发生爆炸性自燃,生成(SiO2)和水。已知室
温下10 g甲硅烷自燃放出热量446 kJ,表示其燃烧热的热化学方程式为:
________________________________________________________________________。
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1 mol Cl2参与反应时释放145 kJ的热量,写出这个反应的热化学方程式:
_________________________________________________________________________。
(1)1.6NA,173.4
(2)1/2H2SO4(aq) + NaOH(aq) = 1/2Na2SO4(aq) + H2O (l) ΔH=-57.3 kJ·mol-1
(3)SiH4(l)+2O2(g)===SiO2(s)+2H2O(l) ΔH=-1427.2 kJ/mol
(4)2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g) ΔH=-290 kJ/mol
(2)1/2H2SO4(aq) + NaOH(aq) = 1/2Na2SO4(aq) + H2O (l) ΔH=-57.3 kJ·mol-1
(3)SiH4(l)+2O2(g)===SiO2(s)+2H2O(l) ΔH=-1427.2 kJ/mol
(4)2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g) ΔH=-290 kJ/mol
试题分析:(1)由题中的热力学方程式,可知
2CH4(g)+ 4 NO2 (g)=" 2" N2(g)+ 2CO2 (g)+4 H2O(g)ΔH=-1734 kJ· mol-1,该反应转移的电子数为8,标准状况下4.48L CH4为0.2mol,所以转移的电子总数为1.6NA,放出的热量为173.4kJ;(2)1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,其热化学方程式为1/2H2SO4(aq) + NaOH(aq) = 1/2Na2SO4(aq) + H2O (l) ΔH=-57.3 kJ·mol-1;(3)中根据题意先写出化学方程式,SiH4(l)+2O2(g)===SiO2(s)+2H2O(l) ,已知10 g甲硅烷自燃放出热量446 kJ,所以1mol放出的热量为446
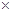
 kJ=1427.2 kJ,所以其热化学方程式为
kJ=1427.2 kJ,所以其热化学方程式为SiH4(l)+2O2(g)===SiO2(s)+2H2O(l) ΔH=-1427.2 kJ/mol,(4)中根据题意先写出化学方程式,2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g),放出的热量为145 kJ×2=290kJ,所以其热力学方程式为2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g) ΔH=-290 kJ/mol 。
点评:本题考查了根据给出的现象书写热力学方程式,是高考考查的重点,本题的信息量较大,有一定的难度。

练习册系列答案
相关题目






 2H2O
2H2O CaO+CO2↑
CaO+CO2↑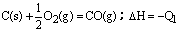 C(s) + O2(g)=CO2(g);△H=-Q2
C(s) + O2(g)=CO2(g);△H=-Q2