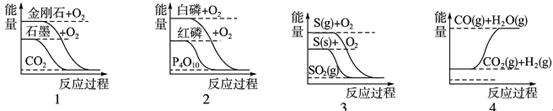
题目内容
在同温同压下,下列各组热化学方程式Q2>Q1的是( )
| A.2H2(g) + O2(g)=2H2O(l);△H=-Q1 2H2(g) + O2(g)=2H2O(g);△H=-Q2 |
| B.S(g) + O2(g)=SO2(g);△H=-Q1 S(s) + O2(g)=SO2(g);△H=-Q2 |
C.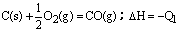 C(s) + O2(g)=CO2(g);△H=-Q2 C(s) + O2(g)=CO2(g);△H=-Q2 |
D.H2(g) + Cl2(g)=2HCl(g);△H=-Q1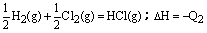 |
C
试题分析:反应放出或吸收的热量的多少,跟反应物和生成物的聚集状态有密切关系。A中两式仅生成物中水的状态不同,由于生成液态水比生成气态水放热多,所以Q1>Q2;B中两式仅硫的状态不同,由于固态硫变成气态硫要吸收热量,所以Q1>Q2;C中固态碳与氧气完全反应生成二氧化碳,放出的热量Q2应大于不完全燃烧时生成一氧化碳放出的热量Q1;D中二式各物质的量不同,有Q1=2Q2的关系,故本题的答案应为C。
点评:该是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力和方法的培养与训练,有利于培养学生的逻辑推理能力和发散思维能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确影响反应热大小的因素,然后结合题意灵活运用即可。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目