题目内容
以下是一些物质的熔沸点数据(常压):
| | 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:
4 Na(g)+ 3CO2(g)
 2 Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol
2 Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol(1)上述反应的平衡常数表达式为 ;若4v正(Na)=3v逆(CO2),反应是否达到平衡 (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1680℃,若反应时间为10min, 金属钠的物质的量减少了0.20mol,则10min里CO2的平均反应速率为 。
(3)高压下有利于金刚石的制备,理由是 。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(l)的热化学方程式 。
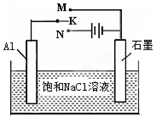
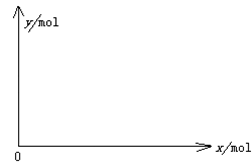
(5)下图开关K接M时,石墨作 极,电极反应式为 。K接N一段时间后测得有0.3mol电子转移,作出y随x变化的图象〖x—代表n(H2O)消耗,y—代表n[Al(OH)3],反应物足量,标明有关数据〗
(16分)
(1) K=1/c4(Na) c3(CO2)(2分)(指数错误或出现固体或液体表示浓度的0分,浓度c大小写不扣分);
否(2分)
(2)0.0015 mol/(L ·min)或0.0005 mol/(L ·min)或0.0015 mol/(L ·min)—0.0005 mol/(L ·min)间任意数值即可得满分(2分);单位错误或没写扣1分。
(3)增大压强,平衡向正反应方向(体积缩小的方向,生成金刚石的方向)移动(2分);(写“反应”移动不扣分)。
(4)6Na2O(s)+2C(s,金刚石)=8Na(g)+2Na2CO3(l) △H=—8.4kJ/mol或3Na2O(s)+ C(s,金刚石)=4Na(g)+Na2CO3(l) △H=—4.2kJ/mol(2分)(方程式错误0分;状态和焓变单位错1或全错都只扣1分;系数减半满分;与系数匹配的焓变数值有误扣1分。)
(5)正(2分);O2+2H2O+4e- =4OH-(2分)(电极反应式错或未配平0分);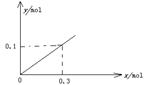 (2分)
(2分)
(线段不出头不扣分;未标数值或标注错误扣1分,直线画为曲线0分)
解析试题分析:(1)固体、纯液体的浓度是常数,因此不能写入平衡常数表达式,则K=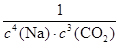 ;不同物质表示的正反应速率和逆反应之比等于化学方程式中对应的系数之比,说明该反应已经达到平衡,即
;不同物质表示的正反应速率和逆反应之比等于化学方程式中对应的系数之比,说明该反应已经达到平衡,即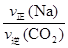 =
=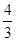 ,所以3v正(Na)=4v逆(CO2)才能说明该反应达到平衡,而4v正(Na)=3v逆(CO2)不能说明反应达到平衡;(2)碳酸钠的分解温度为1850℃,则1680℃时容器中仍发生的反应为4 Na(g)+3CO2(g)
,所以3v正(Na)=4v逆(CO2)才能说明该反应达到平衡,而4v正(Na)=3v逆(CO2)不能说明反应达到平衡;(2)碳酸钠的分解温度为1850℃,则1680℃时容器中仍发生的反应为4 Na(g)+3CO2(g) 2 Na2CO3(l)+ C(s,金刚石),先根据定义式求v(Na),再根据速率之比等于化学方程式中的系数之比求v(CO2),即v(Na)=
2 Na2CO3(l)+ C(s,金刚石),先根据定义式求v(Na),再根据速率之比等于化学方程式中的系数之比求v(CO2),即v(Na)=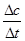 =
=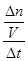 =
=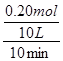 =0.0020mol/(L?min),由于
=0.0020mol/(L?min),由于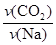 =
=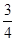 ,v(CO2)="3" v(Na)/4=0.0015mol/(L?min),注意保留两位有效数字;(3)4 Na(g)+3CO2(g)
,v(CO2)="3" v(Na)/4=0.0015mol/(L?min),注意保留两位有效数字;(3)4 Na(g)+3CO2(g) 2 Na2CO3(l)+ C(s,金刚石)的正反应是气体体积减小的方向,增大压强增大两反应物浓度时,不仅反应速率加快,而且平衡向正反应方向移动,使金刚石的制备不仅速率快而且产量多;(4)将已知两个热化学方程式编号为①②,①—②×3可以约去3 CO2(g),根据盖斯定律,则6Na2O(s)+2C(s,金刚石)=8Na(g)+2Na2CO3(l) △H=—8.4kJ/mol,若系数减半,则焓变也减半,则3Na2O(s)+ C(s,金刚石)=4Na(g)+Na2CO3(l) △H=—4.2kJ/mol;(5)若K接M,则该装置为原电池,模拟铝的吸氧腐蚀,由于铝比石墨活泼,则铝是负极,石墨是正极,负极反应式为Al—3e—=Al3+,正极反应式为O2+4e—+2H2O=4OH—;若K接N,该装置变为电解池,则铝是阳极,石墨是阴极,溶液中的氢离子和钠离子移向阴极,阴极反应式为2H++2e—=H2↑或2H2O+2e—=H2↑+2OH—,阳极反应式为Al—3e—=Al3+,则电解总反应式为2Al+6H2O
2 Na2CO3(l)+ C(s,金刚石)的正反应是气体体积减小的方向,增大压强增大两反应物浓度时,不仅反应速率加快,而且平衡向正反应方向移动,使金刚石的制备不仅速率快而且产量多;(4)将已知两个热化学方程式编号为①②,①—②×3可以约去3 CO2(g),根据盖斯定律,则6Na2O(s)+2C(s,金刚石)=8Na(g)+2Na2CO3(l) △H=—8.4kJ/mol,若系数减半,则焓变也减半,则3Na2O(s)+ C(s,金刚石)=4Na(g)+Na2CO3(l) △H=—4.2kJ/mol;(5)若K接M,则该装置为原电池,模拟铝的吸氧腐蚀,由于铝比石墨活泼,则铝是负极,石墨是正极,负极反应式为Al—3e—=Al3+,正极反应式为O2+4e—+2H2O=4OH—;若K接N,该装置变为电解池,则铝是阳极,石墨是阴极,溶液中的氢离子和钠离子移向阴极,阴极反应式为2H++2e—=H2↑或2H2O+2e—=H2↑+2OH—,阳极反应式为Al—3e—=Al3+,则电解总反应式为2Al+6H2O 2Al(OH)3+3H2↑~6e—,若转移0.3mol电子,则被消耗的水为0.3mol;由于该反应中氢氧化铝与水的系数之比等于物质的量之比,则
2Al(OH)3+3H2↑~6e—,若转移0.3mol电子,则被消耗的水为0.3mol;由于该反应中氢氧化铝与水的系数之比等于物质的量之比,则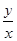 =
=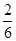 ,即y=x/3;然后在坐标纸上用描点法画图,若x=0,则y=0;x=0.3,则y=0.1,将两点连线即可画图。
,即y=x/3;然后在坐标纸上用描点法画图,若x=0,则y=0;x=0.3,则y=0.1,将两点连线即可画图。
考点:考查化学反应原理,涉及化学平衡常数表达式、化学平衡与否的判断、计算平均反应速率、用反应速率和平衡移动理论解释高压生产金刚石的原因、盖斯定律、原电池和电解原理、电极类型判断、电极反应式、物质的量、氧化还原反应中转移电子的计算、物质的量在化学或离子方程式计算中的应用等。

能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。因此甲醇被称为21世纪的新型燃料。
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol—1
②H2O(l) H2O(g) △H="+" 44.0 kJ.mo—1
写出表示甲醇燃烧热的热化学方程式 。
(2)工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
①在“图1”中,曲线 (填“a”或“b”)表示使用了催化剂。
②能判断该反应在“图2”所在条件下是否已达化学平衡状态的依据是 。(双选)
| A.容器中压强不变 | B.体系的密度不随时间改变 |
| C.v正(H2)=2v逆(CH3OH) | D.CO与H2的物质的量的比不随时间改变 |
 CH3OH(g)的化学平衡常数K= 。
CH3OH(g)的化学平衡常数K= 。④请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(3)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-6。现将c mol·L-1 CaCl2溶液与2.00×10-2 mol·L-1 Na2SO4溶液等体积混合生成沉淀,则c的最小值是 (结果保留3位有效数字)。
常温下钛的化学活性很小,在较高温度下可与多种物质反应。
(1)工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下: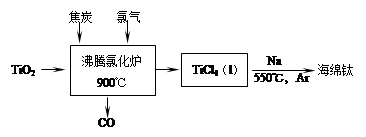
① 沸腾氯化炉中发生的主要反应为: 。
②已知:Ti(s) +2Cl2(g)=TiCl4(l) ΔH=a kJ·mol-1;
2Na(s) +Cl2(g)=2NaCl(s) ΔH=b kJ·mol-1;
Na(s)=Na(l) ΔH=c kJ·mol-1;
则TiCl4(l) +4Na(l)=Ti(s) +4NaCl(s) ΔH= kJ·mol-1。
③ TiCl4遇水强烈水解,写出其水解的化学方程式 。
(2)TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如图所示,二氧化钛电极连接电 极,该极电极反应为: 。但此法会产生有毒气体,为减少对环境的污染,在电池中加入固体氧离子隔膜(氧离子能顺利通过),将两极产物隔开,再将石墨改为金属陶瓷电极,并通入一种还原性气体,该气体是 。
(3)海绵钛可用碘提纯,原理为: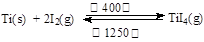 ,下列说法正确的是 。
,下列说法正确的是 。
| A.该反应正反应的ΔH>0 |
| B.在不同温度区域,TiI4的量保持不变 |
| C.在提纯过程中,I2 的作用是将粗钛从低温区转移到高温区 |
| D.在提纯过程中,I2 可循环利用 |
某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用470 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从图中选择称量NaOH固体所需要的仪器是(填字母): 。
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
Ⅱ.测定中和热
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、盐酸、NaOH溶液,尚缺少的实验玻璃用品是 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | |||
| H2SO4 | NaOH | 平均值 | ||||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | | |
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=“4.18”J/(g·℃)。则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
100 mL 6 mol·L-1的H2SO4溶液跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
①Na2CO3溶液 ②水 ③K2SO4溶液 ④KNO3溶液
| A.①③ | B.②③ | C.①④ | D.②④ |
在一定温度下的恒容密闭容器中,能说明反应X2(g)+ Y2(g) 2XY(g) 已达到平衡的是( )
2XY(g) 已达到平衡的是( )
| A.容器中的总压不随时间变化 |
| B.容器中的气体平均相对分子质量不随时间变化 |
| C.容器中的混合气体的密度不随时间变化 |
| D.容器中的各种气体的质量分数不随时间变化 |
 2SO3(g) ?H=-196.6 kJ·mol-1
2SO3(g) ?H=-196.6 kJ·mol-1 2NO2(g) ?H=-113.0 kJ·mol-1
2NO2(g) ?H=-113.0 kJ·mol-1 
 H++ SO42-
H++ SO42- 的废水会发生如下反应:
的废水会发生如下反应:
 2NH3(g) △H <0
2NH3(g) △H <0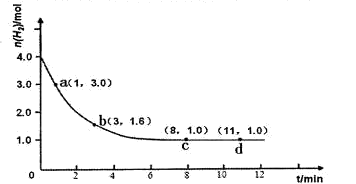
 CO+H2;②CO+H2O(g)
CO+H2;②CO+H2O(g)