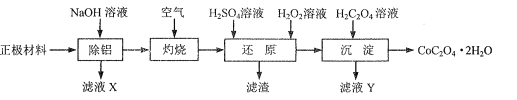
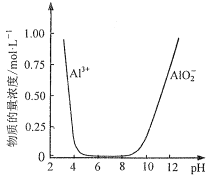
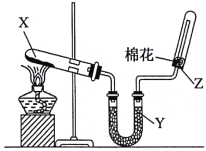
题目内容
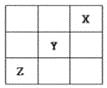
【题目】NO2、O2 和熔融 KNO3 可作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物 Y,Y 可循环使用。下列说法正确的是
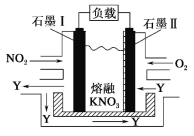
A.放电时,NO![]() 向石墨Ⅱ电极迁移
向石墨Ⅱ电极迁移
B.电池总反应式为 4NO2+O2===2N2O5
C.石墨Ⅱ附近发生的反应为 NO+O2+e- ===NO![]()
D.当外电路通过 4 mol e-,负极上共产生 2 mol N2O5
【答案】B
【解析】
石墨Ⅱ通入O2,则此电极为原电池的正极,则石墨Ⅰ为负极。依据电极原料,可确定发生的反应为4NO2+O2==2N2O5,则负极反应为4NO2-4e-+4NO3-==4N2O5,正极反应为O2+4e-+2N2O5==4NO3-。
A.由以上分析知,放电时,石墨Ⅰ为负极,则NO![]() 向石墨Ⅰ电极迁移,A不正确;
向石墨Ⅰ电极迁移,A不正确;
B.电池放电时,依据以上分析,电池总反应式为 4NO2+O2==2N2O5,B正确;
C.石墨Ⅱ附近发生的反应为O2+4e-+2N2O5==4NO3-,C不正确;
D.负极反应为4NO2-4e-+4NO3-==4N2O5,当外电路通过 4 mol e-,负极上共产生 4mol N2O5,D不正确;
故选B。

 综合自测系列答案
综合自测系列答案【题目】I.(1)写出H2CO3的电离方程式:__________________________________________。
(2)现有①CH3COOH、②HCl两种溶液,选择填空:
A.①>② B.①<② C.①﹦②
①当它们物质的量浓度相等时,中和等体积、等物质的量浓度的烧碱溶液需两种酸溶液的体积关系为____________。
②当它们氢离子浓度相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为____________。
II.煤化工产业中常用合成气(主要成分是氢气和一氧化碳气体)合成氨和甲醇。请回答:
(1)工业合成氨的化学方程式为N2+3H2![]() 2NH3 ,在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。则该条件下的平衡常数为________。
2NH3 ,在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。则该条件下的平衡常数为________。
(2)合成甲醇的主要反应是2H2(g)+CO(g)![]() CH3OH(g) ΔH=-90.8 kJ·mol-1,t ℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10 min后测得各组分的浓度如:
CH3OH(g) ΔH=-90.8 kJ·mol-1,t ℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10 min后测得各组分的浓度如:
物质 | H2 | CO | CH3OH |
浓度(mol·L-1) | 0.2 | 0.1 | 0.4 |
①该时间段内反应速率v(H2)=________。
②比较此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”)。
③反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,平衡______(填“逆向”、“正向”或“不”)移动,平衡常数K_________(填“增大”、“减小”或“不变”)。