题目内容
【题目】原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期,A基态原子的2p轨道上有2个未成对电子,C的最外层电子数是次外层电子数的3倍,C与D同主族相邻,E位于周期表的ds区,最外层只有一对成对电子。请回答下列问题:
(1)D元素在元素周期表中的位置是_____,基态E原子的电子占有_____种能量不同的原子轨道。
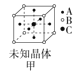
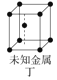
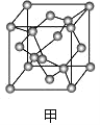
(2)A元素可形成多种单质,其中原子晶体的名称是_____,其每个晶胞(如图甲)实际含有_____个A原子;A有一种单质为层状结构的晶体,晶体中存在的作用力有_____,晶体中每个最小环含有_____个原子。
(3)①化合物AC2的结构式_____。
②写出用足量的氢氧化钠溶液吸收DC2气体的离子方程式_____。
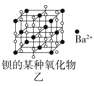
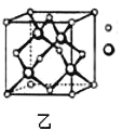
(4)D与E能形成化合物X,X的一种晶体晶胞结构如图乙所示,X的化学式为_____,D离子的配位数为_____。
【答案】第三周期第VIA族 7 金刚石 8 共价键、范德华力 2 O=C=O 2OH-+SO2=SO32-+H2O ZnS 4
【解析】
A原子的![]() 轨道上有2个未成对电子,则可能是
轨道上有2个未成对电子,则可能是![]() 或
或![]() ,C的最外层电子数是次外层电子数的3倍,其电子排布式为
,C的最外层电子数是次外层电子数的3倍,其电子排布式为![]() ,即氧元素,因此A只能是
,即氧元素,因此A只能是![]() ,即碳元素,而B介于A和C之间,为氮元素,C与D同主族相邻,则D为硫元素,E的最外层只有一对成对电子,则只能是
,即碳元素,而B介于A和C之间,为氮元素,C与D同主族相邻,则D为硫元素,E的最外层只有一对成对电子,则只能是![]() ,即锌元素,据此分析来解答本题即可。
,即锌元素,据此分析来解答本题即可。
(1)根据分析D为硫元素,其位于第三周期第![]() 族,而基态E原子中有
族,而基态E原子中有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 一共7个能级,因此有7种能量不同的原子轨道;
一共7个能级,因此有7种能量不同的原子轨道;
(2)碳元素形成的原子晶体即金刚石,在计算一个晶胞中含有的原子数时,位于顶点的原子按![]() 算,位于面心的原子按
算,位于面心的原子按![]() 算,位于晶胞内部的原子按1算,因此一个晶胞内共有
算,位于晶胞内部的原子按1算,因此一个晶胞内共有![]() 个原子;A的一种层状结构的晶体指的是石墨,石墨晶体中存在碳原子与碳原子之间的共价键,以及层间的范德华力,其单层石墨为正六边形密铺结构
个原子;A的一种层状结构的晶体指的是石墨,石墨晶体中存在碳原子与碳原子之间的共价键,以及层间的范德华力,其单层石墨为正六边形密铺结构 ,每个碳原子被3个正六边形共用,因此一个环实际上有
,每个碳原子被3个正六边形共用,因此一个环实际上有![]() 个碳原子;
个碳原子;
(3)①![]() 即二氧化碳,碳和氧之间为双键O=C=O;
即二氧化碳,碳和氧之间为双键O=C=O;
②![]() 即二氧化硫,足量烧碱溶液吸收二氧化硫得到正盐(亚硫酸钠),写出离子方程式即可
即二氧化硫,足量烧碱溶液吸收二氧化硫得到正盐(亚硫酸钠),写出离子方程式即可![]() ;
;
(4)D和E形成的化合物即硫化锌,根据晶胞结构不难看出![]() 的配位数为4。
的配位数为4。

 小学课时特训系列答案
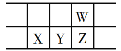
小学课时特训系列答案【题目】下表列出了①~⑨九种元素在周期表中的位置.
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ||||||
4 | ⑧ | ⑨ |
请按要求回答下列问题.
(1)这九种元素中,原子半径最大的是(填元素符号)__;元素⑤的原子结构示意图为___.
(2)③、④、⑤三种元素的气态氢化物中,热稳定性最弱的物质是(填化学式)______.
(3)写出元素⑧的单质与水反应的化学方程式:______.
(4)写出元素⑦的单质与元素⑨的钠盐溶液反应的离子方程式:______.