题目内容
11.下列有关第三周期主族元素的性质,从左到右递变规律不正确的是( )| A. | 原子半径逐渐减小 | B. | 最高正化合价逐渐增大 | ||
| C. | 电子层数逐渐增多 | D. | 元素的非金属性逐渐增强 |
分析 同周期从左到右最外层电子数逐渐增多,得电子能力增强,非金属性逐渐增强,原子半径逐渐减小,最高正化合价等于最外层电子数,据此分析.
解答 解:A、同周期从左到右,原子半径逐渐减小,故A正确;
B、同周期从左到右最外层电子数逐渐增多,最高正化合价等于最外层电子数,所以最高正化合价逐渐增大,故B正确;
C、第三周期主族元素,电子层数为3,所以电子层数相同,故C错误;
D、同周期从左到右最外层电子数逐渐增多,得电子能力增强,非金属性逐渐增强,故D正确;
故选:C.
点评 本题考查学生元素周期律的应用知识,注意把握同周期元素的递变性,难度不大.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
1.丙烷的分子结构可简写成键线式结构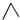 ,有机物A的键线式结构为
,有机物A的键线式结构为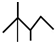 ,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )
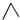 ,有机物A的键线式结构为
,有机物A的键线式结构为 ,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )| A. | 用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷 | |
| B. | 有机物A的一氯取代物只有4种 | |
| C. | 有机物A的分子式为C8H18 | |
| D. | B的结构可能有3种,其中一种名称为3,4,4-三甲基-2-戊烯 |
2.下列说法正确的是( )
| A. | 由分子组成的物质中一定存在共价键 | |
| B. | 由非金属元素组成的化合物一定是共价化合物 | |
| C. | 非极性键只存在双原子分子中 | |
| D. | 两个非金属元素原子间不可能形成离子键 |
6.下列说法正确的是( )
| A. | 除去乙烯中混有的甲烷,可将混合气体通过酸性高锰酸钾溶液 | |
| B. | 含有醛基和羰基的有机物都能跟银氨溶液发生银镜反应 | |
| C. | 苯乙烯分子中所有原子可能在一个平面上 | |
| D. | 甲酸分子中有醛基,因此无法区别甲醛溶液和甲酸溶液 |
16.X、Y均为短周期元素,X原子的最外层有2个电子,Y原子的最外层有6个电子,这两种元素形成的化合物的化学式是( )
| A. | XY2 | B. | X2Y3 | C. | X2Y | D. | XY |
3.下列分子式表示的物质,有两种同分异构体的是( )
| A. | C3H8 | B. | C3H7Cl | C. | CH2Cl2 | D. | C2H6O |
20.下列物质中有固定熔点的是( )
| A. | 聚乙烯 | B. | 氯化钠 | C. | 淀粉 | D. | 聚1,3-丁二烯 |
 若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答:
若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答: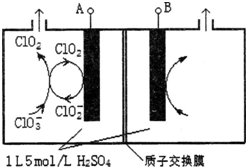 研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.