题目内容
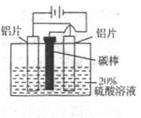
某小组按图1所示的装置探究铁的吸氧腐蚀。完成下列填空:

(1)图2 是图1所示装置的示意图,在图2的小括号内填写正极材料的化学式;在方括号内用箭头表示出电子流动的方向。
(2)写出正、负极反应的方程式。正极: ,负极: 。
(3)按图1装置实验,约8分钟才看到的导管中液柱上升,下列措施可以更快更清晰地观察到液柱上升的是 。
a.用纯氧气代替具支试管内的空气
b.用食盐水浸泡过的铁钉再蘸取铁粉和炭粉的混合物
c.用毛细尖嘴管代替玻璃导管,并向试管的水中滴加少量红墨水
(4)升高温度可以加快化学反应速率,建议用酒精灯加热具支试管。这一措施 (填“可行”或“不行”)。
(5)有同学观察到图1装置在组装时就会使导管中液面低于试管中液面,导致实验时导管中液柱上升需要更多的时间。图1装置组装时,使导管中液面低于试管中液面的原因是 。消除这一现象的简单操作是 。
(1)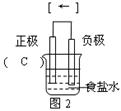 (各1分,共2分)
(各1分,共2分)
(2)2H2O+ O2+4e→4OH- (1分)Fe-2e→Fe2+(1分)
(3)a b c (3分)
(4)不行(1分)
(5)不论是后塞塞子还是后将导管插入水中,都会造成容器中气体体积减小,压强增大,使导管中液面低于试管中液面(2分);用针筒从橡胶塞处抽气或把橡皮塞换成带分液漏斗的单孔塞(2分,合理即给分)
解析试题分析:(1)氯化钠溶液显中性,所以在食盐水中,铁钉发生吸氧腐蚀,铁作负极,碳作正极,电子从铁沿导线流向正极碳,其图象为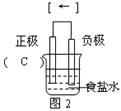
(2)该装置中,负极上铁失电子发生氧化反应,电极反应式为Fe-2e-=Fe2+;正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4 e-=4OH -。
(3)a.用纯氧气代替具支试管内的空气,氧气的浓度增大,反应速率加快,故a正确;b.用食盐水浸泡过的铁钉再蘸取铁粉和炭粉的混合物,增大反应物的接触面积,反应速率加快,故b正确;c.用毛细尖嘴管代替玻璃导管,并向试管的水中滴加少量红墨水,改变相同的压强即改变相同的体积,毛细尖嘴管上升的高度大于玻璃导管,且红墨水现象更明显,故c正确,所以答案选a b c。
(4)温度越高,氧气的溶解度越小,反应速率越小,所以用酒精灯加热具支试管,降低反应速率,因此这一措施是不行的。
(5)一定量的气体,压强与气体体积成反比,体积越小,压强越大,导致导管中液面低于试管中液面,所以可以采用用针筒从橡胶塞处抽气或把橡皮塞换成带分液漏斗的单孔塞的方法消除这一现象。因此使导管中液面低于试管中液面的原因是不论是后塞塞子还是后将导管插入水中,都会造成容器中气体体积减小,压强增大,使导管中液面低于试管中液面;所以消除这一现象的简单操作是用针筒从橡胶塞处抽气或把橡皮塞换成带分液漏斗的单孔塞。
考点:考查铁发生吸氧腐蚀原理的实验探究以及实验方案设计与评价等

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu + H2O  Cu2O + H2↑。 Cu2O + H2↑。 |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成 而使Cu2O产率降低。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H = kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为 。
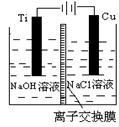
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为 。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
水蒸气的浓度(mol/L)随时间t(min)变化如下表所示。
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
A.实验的温度T2小于T1
B.实验①前20 min的平均反应速率v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂催化效率高
把M mol H2和N mol C2H4混合, 在一定条件下使它们一部分发生反应生成W mol C2H6, 将反应后所得的混合气体完全燃烧, 消耗氧气的物质的量为 ( )
| A.M + 3N mol | B.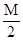 + 3N mol + 3N mol | C.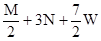 mol mol | D.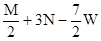 mol mol |
某物质可能含有:a.甲酸、b.乙酸、c.甲醇、d.甲酸甲酯四种物质中的一种或几种,在鉴别时有下列现象:①可发生银镜反应;②加入新制Cu(OH)2悬浊液,沉淀不溶解;③与含酚酞的NaOH溶液共热,发现溶液中红色逐渐变浅至无色.下列叙述中,正确的是( )
| A.a、b、c、d都有 | B.一定无a,一定有b,可能有c、d |
| C.有c和d | D.一定有d,可能有c,一定无a、b |
用括号中的试剂除去各组中的杂质,不正确的是
| A.苯中的甲苯(溴水) | B.乙醇中的水(新制CaO) |
| C.甲烷中的乙烯(溴水) | D.乙酸乙酯中的乙酸(饱和Na2CO3溶液) |
β—紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。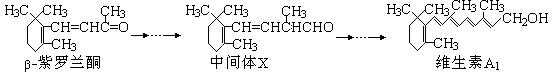
下列说法正确的是
| A.β—紫罗兰酮可使酸性KMnO4溶液褪色 |
| B.1mol中间体X最多能与2molH2发生加成反应 |
| C.维生素A1易溶于NaOH溶液 |
| D.β—紫罗兰酮与中间体X互为同分异构体 |
 3Zn+2K2FeO4+8H2O,该电池放电时正极材料的化学式是 其电极反应式是______,若电路中通过1.204×1023个电子时,负极质量变化为______g充电时,该电池的正极接直流电源的______(填“正极”或“负极”)。
3Zn+2K2FeO4+8H2O,该电池放电时正极材料的化学式是 其电极反应式是______,若电路中通过1.204×1023个电子时,负极质量变化为______g充电时,该电池的正极接直流电源的______(填“正极”或“负极”)。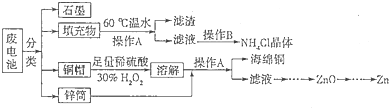


 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O